题目内容
5.已知2Fe3++2Br-=2Fe2++Br2,当把Cl2通入FeBr2溶液中时,下列离子方程式一定不正确的是( )| A. | Cl2+2Br-=Br2+2Cl- | |
| B. | 4Cl2+6Br-+2Fe2+=2Fe3++3Br2+8Cl- | |
| C. | 3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl- | |
| D. | 2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl- |
分析 因溴离子的还原性大于亚铁离子的还原性,所以把Cl2通入FeBr2溶液中时,氯气先氧化溴离子,再氧化亚铁离子,以此来解答.
解答 解:A.溴离子的还原性大于亚铁离子的还原性,所以把Cl2通入FeBr2溶液中时,氯气先氧化溴离子,故A正确;
B.氯气与溴离子发生置换反应生成氯离子和溴,氯气不足时,氧化溴离子完全后,氧化部分的亚铁离子,故B正确;
C.氯气与溴化亚铁完全反应,3Cl2+2Fe2++4Br-=2Fe3++2Br2+6Cl-遵循电子、电荷守恒,故C正确;
D.氯气与溴化亚铁反应的离子方程式中,n(Br-)/n(Fe2+)≥2,而所给离子方程式中n(Br-)/n(Fe2+)=1<2,所以不可能发生,故D错误,
故选D.
点评 本题考查了离子方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意已知信息及氧化的先后顺序,注意离子反应中保留化学式的物质及电子和电荷守恒,题目难度中等.

练习册系列答案
相关题目
15.下列物质中既有离子键又有共价键的是( )
| A. | CaO | B. | CO2 | C. | K2O | D. | Ca(OH )2 |
13.用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol 的CuO和0.1molH2O后恰好恢复到电解前的浓度,则电解过程中阳极产生的气体在标准状况下的体积为( )
| A. | 2.24L | B. | 3.36L | C. | 1.12L | D. | 4.48L |
17.下列表示对应化学反应的离子方程式正确的是( )
| A. | 加入NaClO将污水中的NH3氧化成N2:3ClO-+2NH3═N2↑+3Cl-+3H2O | |
| B. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+═SO2↑+H2O | |
| C. | NaAlO2溶液中AlO2-的水解:AlO2-+2H2O═Al(OH)3↓+OH- | |
| D. | 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- |
14.如图所示有机物的一氯取代物有(不含立体异构)( )


| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
10.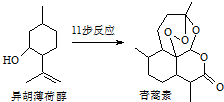 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
 2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )
2015年诺贝尔生理学、医学奖的一半授予我国药物化学家屠吆吆,以表彰她发明抗疟疾新药青蒿素和双氢青蒿素.以异胡薄荷醇为起始原料是人工全合成青蒿素的途径之一(如图).下列说法正确的是( )| A. | 异胡薄荷醇的分子式为C10H12O | |
| B. | 青蒿素提取时可以通过加热或加碱溶解的方法提高其浸取率 | |
| C. | 青蒿素易溶于水,而难溶于有机溶剂 | |
| D. | 异胡薄荷醇可发生消去反应 |
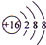
 2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色
2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色

 ;壬的结构简式
;壬的结构简式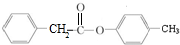


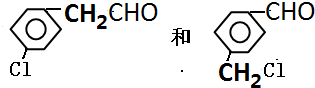 (任写一种)
(任写一种)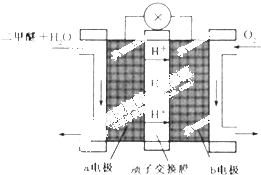 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: