题目内容
11.实验室配制80mL 1mol/L硫酸铜溶液,正确的操作是( )| A. | 称量12.8gCuSO4溶解在100mL水中 | |
| B. | 称量25.0gCuSO4•5H2O晶体溶于100mL水中 | |
| C. | 称量16.0gCuSO4溶于水,然后稀释至100mL | |
| D. | 称量20.0gCuSO4•5H2O晶体溶于水,然后稀释至100mL |
分析 配制80ml 1mol/L硫酸铜溶液,选择100mL容量瓶,结合m=cVM计算溶质的质量,溶液体积为100mL,以此来解答.
解答 解:A.溶解在100ml水中,为溶剂的体积,故A不选;
B.溶于100mL水中,为溶剂的体积,溶液体积未知,不能计算,故B不选;
C.n(CuSO4)=$\frac{16.0g}{160g/mol}$=0.1mol,溶于水,然后稀释至100mL,浓度为$\frac{0.1mol}{0.1L}$=1mol/L,故C选;
D.溶于水,然后稀释至100mL,溶液体积为0.1L,但20.0gCuSO4•5H2O,物质的量小于0.1mol,故D不选;
故选C.
点评 本题考查配制一定物质的量浓度的溶液,为高频考点,把握浓度、物质的量及质量的关系为解答的关键,侧重分析与实验能力的考查,注意溶液体积的判断,题目难度不大.

练习册系列答案
相关题目
1. 25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
 25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )
25℃时,已知AgCl的Ksp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是( )| A. | Ag2CO3的Ksp为8.1×10-12 | |
| B. | Ag2CO3(s)+2Cl-(aq)?2AgCl(s)+CO32-(aq)平衡常数K=2.5×108 | |
| C. | 在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点) | |
| D. | 在0.001mol•L-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀 |
6.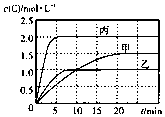 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
| A. | 若平衡时温度不变,改变容器体积平衡不移动 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | l0min内甲容器中反应的平均速率v(A)=0.025mol•(L•min)-1 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |
16.第四届“绿发会”主题是“绿色发展让世界更美好”,下列行为不符合这一宗旨的是( )
| A. | 提高风能、太阳能等可再生清洁能源的使用比例 | |
| B. | 推广CO2再利用技术,将其合成有价值的化学品 | |
| C. | 利用工业废水灌溉农作物,提高水资源的利用率 | |
| D. | 研发煤炭的洁净、高效利用技术,保护生态环境 |
3.用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )
| A. | 石蕊,由蓝变红 | B. | 酚酞,红色褪去 | C. | 甲基橙,由黄变橙 | D. | 甲基橙,由橙变黄 |
20.向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生CuI白色沉淀,蓝色溶液变为棕色.再向反应后的溶液中通入过量的SO2气体,溶液变成无色.则下列说法正确的是( )
| A. | 通入22.4LSO2参加反应时,有2 NA个电子发生转移 | |
| B. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| C. | 滴加KI溶液时,KI被氧化,CuI是氧化产物 | |
| D. | 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性 |
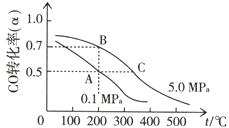 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.