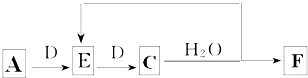
题目内容
19.C、N、Na、Cu、O、Si、S、Cl是常见的八种元素.(1)S在元素周期表的位置是第三周期,第ⅥA族;Cl?的离子结构示意图是
 ;Na2O2的电子式
;Na2O2的电子式 .
.(2)用“>”或“<”填空:
| 非金属性 | 离子半径 | 热稳定性 | 酸性 |
| N<Cl | S2->Na+ | NH3<H2O | H2SO4 >HClO |
(4)气体分子(CN)2的结构式为N≡C-C≡N,(CN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH═NaCN+NaOCN+H2O.
分析 (1)S是16号元素,三个电子层,最外层6个电子;根据核外电子层排布,氯离子的结构示意图为: ;Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
;Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ;
;
(2)非金属性Cl>N,电子层越多半径越大,硫离子三个电子层,而钠离子二个电子层,非金属性越强对应氢化物越稳定;硫酸是强酸而次氯酸是弱酸;
(3)根据题干描述书写化学方程式,注意焓变与物质的量的对应关系、注明各物质的状态;
(4)(CN)2分子中各原子最外层都达到8电子稳定结构,据此写出其结构式;类比氯气与氢氧化钠溶液的反应写出该反应化学方程式.
解答 解:(1)S是16号元素,三个电子层,最外层6个电子,所以:硫是第三周期,第ⅥA族;根据核外电子层排布,氯离子的结构示意图为 ;Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
;Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为:第三周期,第ⅥA族; ;
; ;
;
(2)非金属性Cl>N,电子层越多半径越大,硫离子三个电子层,而钠离子二个电子层,所以硫离子的半径大于钠离子,非金属性越强对应氢化物越稳定,氧的非金属性强于氮的非金属性,所以水比氨气稳定;硫酸是强酸而次氯酸是弱酸;故答案为:<;>;<;>;
(3)该反应每消耗1.5mol CuCl(s),放热66.6kJ,消耗4mol CuCl(s),则放热66.6kJ×$\frac{4}{1.5}$=177.6kJ,根据热化学方程式的书写方法,可以写出该反应的热化学方程式为4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol;
(4)(CN)2的化学性质和卤素很相似,其分子中该原子最外层都达到8电子稳定结构,则其结构式为:N≡C-C≡N;由Cl2+2NaOH=NaCl+NaClO+H2O可知,则(CN)2与NaOH溶液反应的化学方程式为:(CN)2+2NaOH=NaCN+NaCNO+H2O,
故答案为:N≡C-C≡N;(CN)2+2NaOH═NaCN+NaOCN+H2O.
点评 本题考查知识点较多,涉及原子结构和元素周期律、反应热的计算和化学方程式书写,为高考常见题型,侧重于学生计算能力、分析比较能力的培养.

| 装置 | 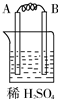 甲 甲 | 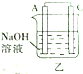 | 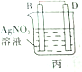 | 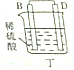 |
| 现象 | A不断溶解 | A极有气泡产生 | B电极质量增加 | B、D电极均无明显变化 |
(1)A、D分别为Al、Cu.
(2)乙装置中C电极的电极反应式为2H2O+2e-═H2↑+2OH-.
(3)上述实验证明了“利用金属活动性顺序可直接判断原电池的正负极”,这种做法不可靠(填“可靠”或“不可靠”)
| A. | 硫酸氢钠稀溶液 | B. | 硝酸钠溶液 | C. | 醋酸钠溶液 | D. | 硫酸铜溶液 |
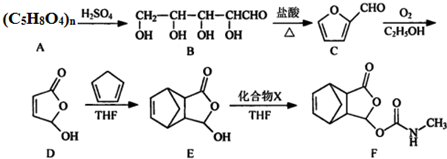
 .
.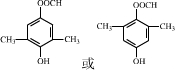 .
.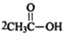 $\stackrel{P_{2}O_{3}}{→}$
$\stackrel{P_{2}O_{3}}{→}$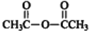 ,化合物
,化合物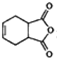 是合成抗病毒药阿普洛韦的中间体,请设计合理方案以
是合成抗病毒药阿普洛韦的中间体,请设计合理方案以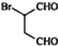 和
和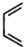 为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
为原料合成该化合物(用合成路线流程图表示:并注明反应条件).合成路线流程图实力如下CH3CH2OH$→_{170℃}^{浓硫酸}$CH2═CH2$\stackrel{Br_{2}}{→}$
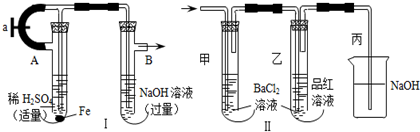
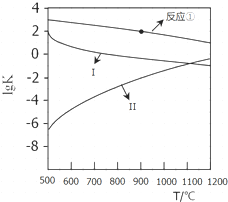 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
. ;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)