题目内容
14.足量的Zn与一定量稀硫酸反应制备氢气,加入下列溶液,能减慢反应速率但不影响生成氢气量的是( )| A. | 硫酸氢钠稀溶液 | B. | 硝酸钠溶液 | C. | 醋酸钠溶液 | D. | 硫酸铜溶液 |
分析 反应的实质为Zn+2H+═Zn2++H2↑,为了减缓反应速率,但又不影响生成氢气的总量,则减小氢离子的浓度但不能改变氢离子的物质的量即可,以此来解答.
解答 解:A.加入硫酸氢钠,氢离子的物质的量增大,则生成氢气量增多,故A错误;
B.加入硝酸钠,锌与硝酸反应不生成氢气,故B错误;
C.加入CH3COONa固体,硫酸变为醋酸,氢离子的浓度减小但不能改变氢离子的物质的量,则减慢反应速率,又不影响生成氢气的总量,故C正确;
D.加入硫酸铜,锌不过置换出Cu,形成锌铜原电池,加快反应速率,故D错误;
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,把握温度、浓度、原电池对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.下列实验能达到预期目的是( )
| A. | 定性检验C2H5Cl中的氯元素:将C2H5Cl和NaOH溶液混合加热后,再加AgNO3溶液 | |
| B. | 检验汽油是否含有烯烃:取少量汽油,加入碘酒,振荡并观察 | |
| C. | 制乙烯:将无水乙醇加热到170℃ | |
| D. | 蛋白质变性实验:将硫酸铜溶液滴入鸡蛋清溶液中 |
2.固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某同学对该固体进行了如下实验,
下列判断正确的是( )
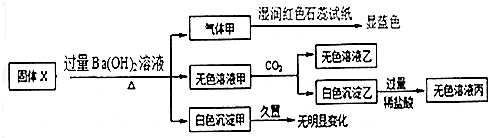
下列判断正确的是( )

| A. | 气体甲一定是纯净物 | |
| B. | 白色沉淀乙不一定是Al(OH)3 | |
| C. | 固体X中一定存在 (NH4)2SO4、MgCl2、AlCl3 | |
| D. | 固体X中一定存在FeCl2、AlCl3 |
19.C、N、Na、Cu、O、Si、S、Cl是常见的八种元素.
(1)S在元素周期表的位置是第三周期,第ⅥA族;Cl?的离子结构示意图是 ;Na2O2的电子式
;Na2O2的电子式 .
.
(2)用“>”或“<”填空:
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1.5mol CuCl(s),放热66.6kJ,该反应的热化学方程式是4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
(4)气体分子(CN)2的结构式为N≡C-C≡N,(CN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH═NaCN+NaOCN+H2O.
(1)S在元素周期表的位置是第三周期,第ⅥA族;Cl?的离子结构示意图是
 ;Na2O2的电子式
;Na2O2的电子式 .
.(2)用“>”或“<”填空:
| 非金属性 | 离子半径 | 热稳定性 | 酸性 |
| N<Cl | S2->Na+ | NH3<H2O | H2SO4 >HClO |
(4)气体分子(CN)2的结构式为N≡C-C≡N,(CN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH═NaCN+NaOCN+H2O.
3.化学与生活、生产密切相关.下列说法不正确的是( )
| A. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| B. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| C. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
4.胶体分散系在日常生活中很常见.下列说法正确的是( )
| A. | Fe(OH)3易溶于水形成胶体 | |
| B. | CuSO4溶液可观察到丁达尔现象 | |
| C. | Fe(OH)3胶体可观察到丁达尔现象 | |
| D. | 胶体分散系中所有粒子的直径都在1~1000 nm之间 |
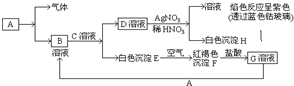 已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;
已知有以下物质相互转化,已知,A是世界上用量最大的金属单质,试回答:(1)写出E的化学式Fe(OH)2F的化学式Fe(OH)3;