题目内容
11.某实验小组按如表中的装置进行实验,已知电极A、B、C、D分别是Mg、Al、Cu、Ag中的一种,| 装置 | 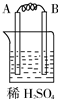 甲 甲 | 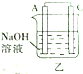 | 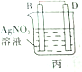 | 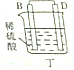 |
| 现象 | A不断溶解 | A极有气泡产生 | B电极质量增加 | B、D电极均无明显变化 |
(1)A、D分别为Al、Cu.
(2)乙装置中C电极的电极反应式为2H2O+2e-═H2↑+2OH-.
(3)上述实验证明了“利用金属活动性顺序可直接判断原电池的正负极”,这种做法不可靠(填“可靠”或“不可靠”)
分析 (1)电极A、B、C、D分别是Mg、Al、Cu、Ag中的一种,
甲中电解质溶液是稀硫酸,看到的现象是:A不断溶解,说明在金属活动性顺序表中A位于H之前,A的活泼性大于B;
乙中A极有气泡产生,能和氢氧化钠溶液反应生成气体的只有Al,所以A是Al;
丁中B、D电极均无明显变化,说明B、D都不和稀硫酸反应,则都位于H之后,应该是Cu、Ag两种金属,则C是Mg;
丙装置中B电极质量增加,说明B作正极,析出金属,则D活动性大于B,D为Cu、B为Ag;
(2)乙装置中Al是负极、Mg是正极,正极C上水得电子生成氢气;
(3)乙中A是Al、C是Mg,较活泼的金属Mg作正极、较不活泼金属Al作负极.
解答 解:(1)电极A、B、C、D分别是Mg、Al、Cu、Ag中的一种,
甲中电解质溶液是稀硫酸,看到的现象是:A不断溶解,说明在金属活动性顺序表中A位于H之前,A的活泼性大于B;
乙中A极有气泡产生,能和氢氧化钠溶液反应生成气体的只有Al,所以A是Al;
丁中B、D电极均无明显变化,说明B、D都不和稀硫酸反应,则都位于H之后,应该是Cu、Ag两种金属,则C是Mg;
丙装置中B电极质量增加,说明B作正极,析出金属,则D活动性大于B,D为Cu、B为Ag,
故答案为:Al;Cu;
(2)乙装置中Al是负极、Mg是正极,正极C上水得电子生成氢气,电极反应式为2H2O+2e-═H2↑+2OH-,故答案为:2H2O+2e-═H2↑+2OH-;
(3)乙中A是Al、C是Mg,较活泼的金属Mg作正极、较不活泼金属Al作负极,所以不能根据金属活泼性强弱判断正负极,所以不可靠,故答案为:不可靠.
点评 本题考查原电池正负极的判断、电极反应式的书写,为高频考点,注意:不能根据金属活泼性强弱判断正负极,要根据给予环境条件下失电子难易程度判断正负极,难点是电极反应式的书写,要结合电解质特点书写.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案| A. | 水 | B. | 氢氧化钠溶液 | C. | 浓盐酸 | D. | 氯化铁溶液 |
下列判断正确的是( )
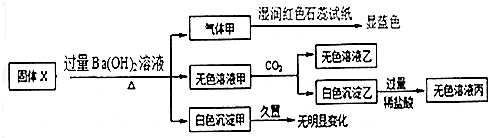
| A. | 气体甲一定是纯净物 | |
| B. | 白色沉淀乙不一定是Al(OH)3 | |
| C. | 固体X中一定存在 (NH4)2SO4、MgCl2、AlCl3 | |
| D. | 固体X中一定存在FeCl2、AlCl3 |
(1)S在元素周期表的位置是第三周期,第ⅥA族;Cl?的离子结构示意图是
 ;Na2O2的电子式
;Na2O2的电子式 .
.(2)用“>”或“<”填空:
| 非金属性 | 离子半径 | 热稳定性 | 酸性 |
| N<Cl | S2->Na+ | NH3<H2O | H2SO4 >HClO |
(4)气体分子(CN)2的结构式为N≡C-C≡N,(CN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH═NaCN+NaOCN+H2O.
| A. | BaCl2+K2SO4═BaSO4↓+2KCl | B. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | ||
| C. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | D. | Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O |