题目内容
8. 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.①$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ?mol-1
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?$\frac{1}{2}$C(s)+$\frac{1}{2}$CO2(g)△H3=-86.2kJ?mol-1
(1)反应2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g)的△H=4△H1+△H2+2△H3(用△H1、△H2和△H3表示)
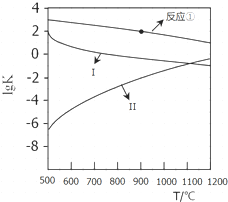
(2)反应①~③的平衡常数的对数lgK随反应温度T的变化曲线见图,结合各反应的△H,归纳lgK~T曲线变化规律:a)当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;b)当温度同等变化时,△H的数值越大lgK的变化越大.
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应①于900℃达到平衡,c平衡(CO)=8.0×10-5 mol?L-1,计算CO的转化率(忽略副反应,结果保留两位有效数字).
(4)为减少副产物,获得更纯净的CO2,可在初始燃料中适量加入碳酸钙.
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,该反应的化学方程式为CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,产物的结构简式为
 .
.
分析 (1)已知:①$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ?mol-1
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?$\frac{1}{2}$C(s)+$\frac{1}{2}$CO2(g)△H3=-86.2kJ?mol-1
根据盖斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g);
(2)由图可知,当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;当温度同等变化时,△H的数值越大lgK的变化越大;
(3)900℃时反应①的lgK=2,则平衡常数为102,设出反应前CO浓度为cmol/L,根据平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$列方程计算解答;
(4)混合气体中含有二氧化硫,可以用碳酸钙进行吸收;
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,则另一种反应为氧气;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,相当于用羧基取代苯环上的氢原子.
解答 解:(1)已知:①$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g)△H1=-47.3kJ?mol-1
②CaSO4(s)+CO(g)?CaO(s)+CO2(g)+SO2(g)△H2=+210.5kJ?mol-1
③CO(g)?$\frac{1}{2}$C(s)+$\frac{1}{2}$CO2(g)△H3=-86.2kJ?mol-1
根据盖斯定律,①×4+②+③×2可得:2CaSO4(s)+7CO(g)?CaS(s)+CaO(s)+6CO2(g)+C(s)+SO2(g),则△H=4△H1+△H2+2△H3,
故答案为:4△H1+△H2+2△H3;
(2)反应①、③为放热反应,随着温度的升高,平衡常数K逐渐减小,则lgK逐渐减小,而反应②为吸热反应,升高温度,平衡常数K逐渐增大,则lgK逐渐增大,所以Ⅰ表示的为反应③、Ⅱ曲线表示的为反应②,可得变化规律为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;
根据反应①和曲线Ⅰ(反应③反应)的反应热可知,当温度同等变化时,△H的数值越大lgK的变化越大,
故答案为:当△H>0时,lgK随温度升高而增大,当△H<0时,lgK随温度升高而减小;当温度同等变化时,△H的数值越大lgK的变化越大;
(3)向盛有CaSO4的真空恒容密闭容器中充入CO,反应方程式为:$\frac{1}{4}$CaSO4(s)+CO(g)?$\frac{1}{4}$CaS(s)+CO2(g),根据图象曲线可知,反应①于900℃时lgK=2,平衡常数为102=100,c平衡(CO)=8.0×10-5 mol•L-1,设一氧化碳反应前浓度为c,则反应消耗的CO浓度=反应生成二氧化碳浓度=(c-8.0×10-5)mol/L,平衡常数K=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{c-8.0×1{0}^{-5}}{8.0×1{0}^{-5}}$=100,解得c=8.08×10-3,一氧化碳的转化率为:$\frac{8.0×1{0}^{-3}}{8.08×1{0}^{-3}}$×100%≈99%,
答:CO的转化率为99%;
(4)混合气体中含有二氧化硫,在原料中加入适量碳酸钙,吸收二氧化硫,有利于获得更纯净的CO2,
故答案为:碳酸钙;
(5)以反应①中生成的CaS为原料,在一定条件下经原子利用率100%的高温反应,可再生CaSO4,则另一种反应为为氧气,该反应的化学方程式为:CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4;在一定条件下,CO2可与对二甲苯反应,在其苯环上引入一个羧基,相当于用羧基取代苯环上的氢原子,对二甲苯中苯环上4个H原子位置等价,则该产物的结构简式为: ,
,
故答案为:CaS+2O2$\frac{\underline{\;高温\;}}{\;}$CaSO4; .
.
点评 本题考查化学平衡计算、化学平衡常数、图象分析、燃烧热计算等,题目难度中等,注意掌握化学平衡常数的概念及计算方法.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案(1)S在元素周期表的位置是第三周期,第ⅥA族;Cl?的离子结构示意图是
 ;Na2O2的电子式
;Na2O2的电子式 .
.(2)用“>”或“<”填空:
| 非金属性 | 离子半径 | 热稳定性 | 酸性 |
| N<Cl | S2->Na+ | NH3<H2O | H2SO4 >HClO |
(4)气体分子(CN)2的结构式为N≡C-C≡N,(CN)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH═NaCN+NaOCN+H2O.
| A. | 低碳生活就是节能减排,使用太阳能等代替化石燃料,可减少温室气体的排放 | |
| B. | 新能源的优点主要是资源丰富、可再生、没有或很少有污染 | |
| C. | 氢能的优点热值高、资源丰富、燃烧产物无污染;缺点是储存和运输困难 | |
| D. | 高纯度的硅单质广泛用于制作光导纤维 |
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeS |
| A. | BaCl2+K2SO4═BaSO4↓+2KCl | B. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | ||
| C. | Ba(NO3)2+H2SO4═BaSO4↓+2HNO3 | D. | Ba(OH)2+2KHSO4═BaSO4↓+K2SO4+2H2O |
正确的是( )
| 选项 | X溶液 | 固体Y | Z溶液 | 现象 |  |
| A | 稀硫酸 | 亚硫酸氢钠 | 品红试剂 | 品红褪色 | |
| B | 浓氨水 | CaO | 紫色石蕊试液 | 溶液变红 | |
| C | 盐酸 | 石灰石 | 硅酸钠溶液 | 出现白色沉淀 | |
| D | 双氧水 | MnO2 | 氢硫酸溶液 | 产生浑浊 |
| A. | A | B. | B | C. | C | D. | D |

| A. | △H>0 | B. | △H<0 | C. | △H=0 | D. | 无法判断 |