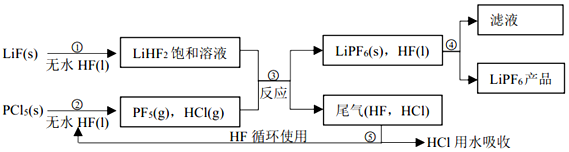
题目内容
13.A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素.A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍; D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6.请回答下列问题:
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是Na>Al>Cl>N>O.
(2)A和C按原子个数比1:l形成4原子分子Y.Y的结构式是H-O-O-H.
(3)分子X的电子式是
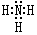 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.(4)实验证明,熔融的EF3不导电,其原因是AlCl3在熔融的状态下不发生电离,没有产生自由移动的离子.
(5)E的单质可溶于A、C、D形成的化合物Z的水溶液中.拉曼光谱证实此反应生成的阴离子主要以E(CA)${\;}_{4}^{-}$的形式存在,写出E溶于Z溶液的离子方程式:2Al+2OH-+6H2O=2Al(OH)4-+3H2↑.
(6)工业品Z的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯.电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
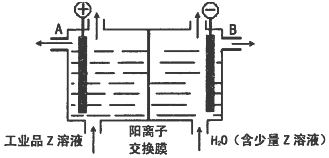
①该电解槽的阳极反应式是4OH--4e-=2H2O+O2↑.
②通电开始后,阴极附近溶液pH增大(“增大”、“减小”或”不变”).
③除去杂质后的Z溶液从液体出口B(填写“A”或“B”)导出.
分析 A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素,A为原子半径最小的元素,为H元素;
A和B可形成4原子10电子的分子X,则B为N元素;
C的最外层电子数是内层的3倍,则C为O元素;
D原子的最外层电子数是最内层电子数的一半,为Na元素;
E是地壳中含量最多的金属元素,为Al元素;
F元素的最高正价与最低负价代数和为6,则F为Cl元素;
(1)原子电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
(2)A和C按原子个数比1:l形成4原子分子Y为H2O2;
(3)分子X是氨气,氨气分子中每个H原子和N原子形成一对共用电子对;D是Na,钠和氨气的反应相当于和水的反应,根据钠和水的反应写出钠和氨气反应;
(4)氯化铝是分子晶体,熔融状态以分子存在;
(5)Al的单质可溶于H、O、Na形成的化合物NaOH的水溶液中.拉曼光谱证实此反应生成的阴离子主要以Al(OH)4-的形式存在,根据反应物和生成物书写离子方程式;
(6)①该电解槽的阳极上氢氧根离子放电;
②通电开始后,阴极上水得电子生成氢气同时生成氢氧根离子,导致阴极附近氢氧根离子浓度增大;
③在阴极附近生成氢氧根离子,阳离子通过交换膜进入阴极室得到NaOH,所以在阴极室得到NaOH.
解答 解:A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素,A为原子半径最小的元素,为H元素;
A和B可形成4原子10电子的分子X,则B为N元素;
C的最外层电子数是内层的3倍,则C为O元素;
D原子的最外层电子数是最内层电子数的一半,为Na元素;
E是地壳中含量最多的金属元素,为Al元素;
F元素的最高正价与最低负价代数和为6,则F为Cl元素,
(1)原子电子层数越多,其原子半径越大,同一周期元素原子半径随着原子序数增大而减小,所以B、C、D、E、F五种元素原子半径由大到小顺序是Na>Al>Cl>N>O,
故答案为:Na>Al>Cl>N>O;
(2)A和C按原子个数比1:l形成4原子分子Y为H2O2,其结构式为H-O-O-H,
故答案为:H-O-O-H;
(3)分子X是氨气,氨气分子中每个H原子和N原子形成一对共用电子对,电子式为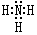 ;D是Na,钠和氨气的反应相当于和水的反应,根据钠和水的反应写出钠和氨气反应为2Na+2NH3=2NaNH2+H2↑,
;D是Na,钠和氨气的反应相当于和水的反应,根据钠和水的反应写出钠和氨气反应为2Na+2NH3=2NaNH2+H2↑,
故答案为: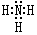 ;2Na+2NH3=2NaNH2+H2↑;
;2Na+2NH3=2NaNH2+H2↑;
(4)氯化铝是分子晶体,熔融状态下以分子存在,熔融的AlCl3不导电,
故答案为:AlCl3在熔融的状态下不发生电离,没有产生自由移动的离子;
(5)Al的单质可溶于H、O、Na形成的化合物NaOH的水溶液中.拉曼光谱证实此反应生成的阴离子主要以Al(OH)4-的形式存在,根据反应物和生成物书写离子方程式为2Al+2OH-+6H2O=2Al(OH)4-+3H2↑,
故答案为:2Al+2OH-+6H2O=2Al(OH)4-+3H2↑;
(6)①该电解槽的阳极上氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2↑,故答案为:4OH--4e-=2H2O+O2↑;
②通电开始后,阴极上水得电子生成氢气同时生成氢氧根离子,导致阴极附近氢氧根离子浓度增大,所以pH增大,故答案为:增大;
③在阴极附近生成氢氧根离子,阳离子通过交换膜进入阴极室得到NaOH,所以在阴极室得到NaOH,所以从B出来,故答案为:B.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及元素推断、元素周期律、离子方程式书写、电解原理等知识点,正确推断元素、灵活运用元素周期律、明确电解原理是解本题关键,注意铝和氢氧化钠溶液反应时NaOH不是氧化剂,为易错点.

(1)SiO2+2C $\frac{\underline{\;高温\;}}{\;}$Si(粗硅)+2CO
(2)Si(粗)+2Cl2$\frac{\underline{\;加热\;}}{\;}$SiCl4
(3)SiCl4+2H2$\frac{\underline{\;高温\;}}{\;}$ Si (纯)+4HCl
对上述三个反应叙述中,不正确的是( )
| A. | (1)(3)为置换反应 | B. | (1)(2)(3)均为氧化还原反应 | ||
| C. | (2)为化合反应 | D. | 反应物中硅元素均被还原 |
| A. | NH4Cl的电子式: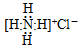 | |
| B. | 对硝基甲苯: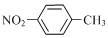 | |
| C. | 碳酸的电离方程式:H2CO3?2H++CO${\;}_{3}^{2-}$ | |
| D. | 硫离子的结构示意图: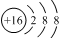 |
| A. | 常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为l×10-24,该溶液中一定可以大量存在K+、Na+、AlO-2、SO2-4 | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| C. | 镍镉可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2$?_{放电}^{充电}$Cd(OH)2+2Ni(OH)2+2H2O,充电时阳极反应为:Ni(OH)2+OH-+e-═NiO(OH)+H2O | |
| D. | 某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O.已知As是产物之一,则该反应配平后H2O的化学计量数为6 |
| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 硫离子的结构示意图: | B. | 乙烯的结构简式为CH2CH2 | ||
| C. | 过氧化氢的电子式: | D. | H2O分子的比例模型 |
 如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.
如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.