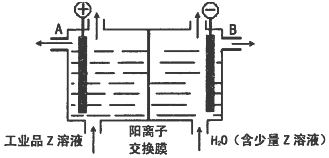
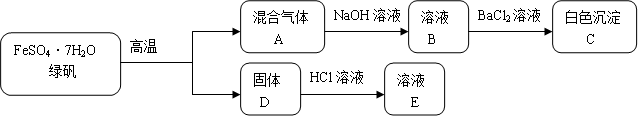
题目内容
18.基于实验现象的推论,你认为合理的是( )| 选项 | 实验现象 | 推论 |
| A | 乙烯气体可以使溴水褪色 | 乙烯发生取代反应 |
| B | 浓硫酸电导率比较低 | 硫酸浓度大时是弱电解质 |
| C | 氨气用于喷泉实验 | 氨气极易溶于水 |
| D | 硝酸溶液使pH试纸先变红后变白 | 硝酸酸性太强不能用pH试纸检测 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙烯中含碳碳双键;
B.浓硫酸为粘稠液体,但硫酸为强电解质;
C.氨气分子间含氢键,极易溶于水;
D.浓硝酸具有强氧化性.
解答 解:A.乙烯中含碳碳双键,与溴水发生加成反应,使其褪色,故A错误;
B.浓硫酸为粘稠液体,不易电离,但硫酸为强电解质,混合物不是电解质也不是非电解质,故B错误;
C.氨气分子间含氢键,极易溶于水,可利用氨气的喷泉实验说明,故C正确;
D.浓硝酸具有强氧化性,则浓硝酸溶液使pH试纸先变红后变白,稀硝酸使pH试纸变红,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.常温下,下列溶液中一定能大量共存的离子组是( )
| A. | 澄清透明的溶液中:NH4+、Cu2+、SO42-、Cl- | |
| B. | 含有大量Fe2+的溶液中:K+、Mg2+、C1O-、SO42- | |
| C. | 加入金属镁能产生H2的溶液中:Na+、Fe2+、SO42-、NO3- | |
| D. | 水电离产生的c(OH-)=l×10-12mol/L的溶液中:Al3+、SO42-、NO3-、Cl- |
9.下列各组顺序的排列不正确的是( )
| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
6.下列说法不正确的是( )
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4g | |
| D. | 减压过滤的原理是抽气泵给吸滤瓶减压,造成吸滤瓶内与布氏漏斗液面上的压力差,从而加快过滤速度 |
3.(1)钠镁铝三种元素中第一电离能最大的是镁.
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)微粒间存在非极性键、配位键、氢键及范德华力的是E.
A.NH4Cl晶体 B.Na3AlF6晶体 C.Na2CO3•10H2O晶体
D.CuSO4溶液 E.CH3COOH溶液
(4)部分共价键键能数据如下表:
根据上表数据推算并写出由氮气和氢气合成氨气的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-93kJ•mol-1.
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
乙醇和二甲醚沸点及水溶性差异的主要原因是乙醇分子间能形成氢键,而二甲醚不能.
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式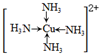 .
.
(2)某正二价阳离子核外电子排布式为[Ar]3d54s0,该金属的元素符号为Mn.
(3)微粒间存在非极性键、配位键、氢键及范德华力的是E.
A.NH4Cl晶体 B.Na3AlF6晶体 C.Na2CO3•10H2O晶体
D.CuSO4溶液 E.CH3COOH溶液
(4)部分共价键键能数据如下表:
| 键 | H-H | N-H | N-N | N=N | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 159 | 418 | 945 |
(5)乙醇和乙醚是同分异构体,但它们性质存在差异:
| 分子式 | 结构简式 | 熔点 | 沸点 | 水溶性 | |
| 乙醇 | C2H6O | C2H5OH | -114.3℃ | 78.4°C | 互溶 |
| 二甲醚 | C2H6O | CH3OCH3 | -138.5℃ | -24.9℃ | 微溶 |
(6)金属铜溶于在浓氨水与双氧水的混合溶液,生成深蓝色溶液.该深蓝色的浓溶液中加入乙醇可见到深蓝色晶体析出,请画出呈深蓝色的离子的结构简式
 .
.
10.某黑色粉末由两种物质组成,为鉴定其成分进行如下实验:
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
| A. | Fe、MnO2 | B. | C、FeS | C. | Si、FeO | D. | CuO、Ag2S |
17.工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为放热反应.现将2molSO2和1molO2充入一密闭容器充分反应后,放出热量a KJ,此时测得SO2的转化率为50%,则下列热化学方程式中正确的是( )
| A. | 2SO2(g)+O2(g)?2SO3(g);△H=-2a KJ/mol | B. | 2SO2(g)+O2(g)2?SO3(g);△H=-a KJ/mol | ||
| C. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=a KJ/mol | D. | SO2(g)+$\frac{1}{2}$O2(g)?SO3(g);△H=-2a KJ/mol |
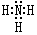 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.