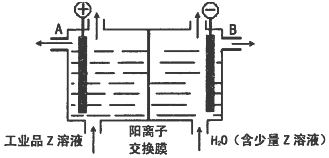
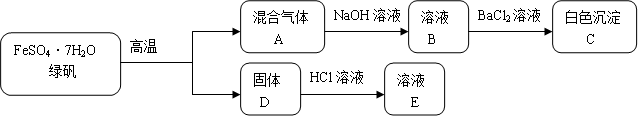
题目内容
2.下列表述正确的是( )| A. | 硫离子的结构示意图: | B. | 乙烯的结构简式为CH2CH2 | ||
| C. | 过氧化氢的电子式: | D. | H2O分子的比例模型 |
分析 A、硫离子的核内有16个质子,核外有18个电子;
B、乙烯的结构简式中碳碳双键不能省略;
C、双氧水为共价化合物;
D、水分子为V型结构,且H原子比O原子小.
解答 解:A、硫离子的核内有16个质子,带16个正电荷,核外有18个电子,故硫离子的结构示意图为 ,故A错误;
,故A错误;
B、乙烯的结构简式中碳碳双键不能省略,故结构简式为CH2=CH2,故B错误;
C、双氧水为共价化合物,电子式为 ,故C错误;
,故C错误;
D、水分子为V型结构,且H原子比O原子小,故比例模型为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了常见化学用语的书写判断,题目难度中等,涉及电子式、离子结构示意图、结构简式等知识,熟练掌握常见化学用语的表示方法为解答关键,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.某黑色粉末由两种物质组成,为鉴定其成分进行如下实验:
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
| A. | Fe、MnO2 | B. | C、FeS | C. | Si、FeO | D. | CuO、Ag2S |
20.用O2将HCl转化为Cl2,可提高效益,减少污染.
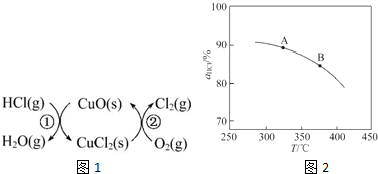
(1)传统上该转化通过如下所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1反应②生成1mol Cl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的转化率αHCl~T曲线如图1:则总反应的△H<0(填“>”“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图1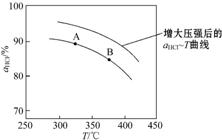 ,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
计算2.0~6.0min内以HCl的物质的量变化表示的反应速率(以mol•min-1为单位)1.8×10-3mol•min-1.
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.

(1)传统上该转化通过如下所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1反应②生成1mol Cl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的转化率αHCl~T曲线如图1:则总反应的△H<0(填“>”“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图1
 ,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
1.短周期主族元素X、Y、Z、M、N的原子序数依次增大.X和M的原子核外均有两个未成对电子,但不处于同一主族.Y、Z、M最高价氧化物对应的水化物两两之间能相互反应.下列叙述正确的是( )
| A. | 原子半径:r(Z)>r(Y)>r(M) | |
| B. | Y和M形成的化合物只含有离子键 | |
| C. | 元素非金属性由弱到强的顺序:M、N、X | |
| D. | 电解N和Z形成的化合物可得到Z的单质 |
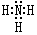 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.