题目内容
1. 如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.
如图表示各物质间的转化关系.已知A、H为离子化合物,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,D、E为单质.请回答:
(1)写出反应①的化学方程式CaC2+2H2O→C2H2↑+Ca(OH)2;
已知B的燃烧热是1300kJ•mol-1,写出反应②的热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol.
(2)G和H的混合物俗称漂白粉,溶于水后呈碱性(填“酸”“碱”“中”),其原因ClO-+H2O?OH-+HClO(用离子方程式表示).
(3)E和NO2在室温下可以化合生成一种新的气态化合物.实验测知:取E和NO2混合气体5L,当E所占体积分数分别为20%、60%,反应后气体的体积均为4L(所有气体体积在相同条件下测得).生成的气态化合物的分子式NO2Cl反应的化学方程式2NO2+Cl2=2NO2Cl.
分析 A、H为离子化合物,能和水反应,生成B和C,B能和D燃烧生成F和水,C和E反应生成水、G和H,
H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,H为CaCl2,D、E为单质,氯气和氢氧化钙反应生成氯化钙、水和次氯酸钙,则C是Ca(OH)2、E是Cl2、G是Ca(ClO)2,A为CaC2,则B为C2H2,D是O2,F为CO2,结合题目分析解答.
解答 解:A、H为离子化合物,能和水反应,生成B和C,B能和D燃烧生成F和水,C和E反应生成水、G和H,H晶体中阴、阳离子的个数比为2:1,常用作干燥剂,H为CaCl2,D、E为单质,氯气和氢氧化钙反应生成氯化钙、水和次氯酸钙,则C是Ca(OH)2、E是Cl2、G是Ca(ClO)2,A为CaC2,则B为C2H2,D是O2,F为CO2;
(1)反应①的化学方程式CaC2+2H2O→C2H2↑+Ca(OH)2;
B的燃烧热是1300kJ•mol-1,反应②的热化学方程式为C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol,
故答案为:CaC2+2H2O→C2H2↑+Ca(OH)2; C2H2(g)+$\frac{5}{2}$O2(g)=2CO2(g)+H2O(l)△H=-1300kJ/mol;
(2)G和H的混合物是次氯酸钙和氯化钙的混合物,俗称漂白粉,次氯酸钙水解导致溶液呈碱性,所以漂白粉溶于水后呈碱性,其原因为 ClO-+H2O?OH-+HClO,
故答案为:漂白粉;碱; ClO-+H2O?OH-+HClO;
(3)取氯气和NO2混合气体5L,当E所占体积分数分别为20%、60%,则E的体积分别是1L、3L,二氧化氮体积分别是4L、2L,反应后气体的体积均为4L,则二氧化氮和氯气以2:1反应,其产物为 NO2Cl,反应方程式为 2NO2+Cl2=2NO2Cl,
故答案为:NO2Cl; 2NO2+Cl2=2NO2Cl.
点评 本题考查无机物推断,为高频考点,侧重考查学生分析推断及知识综合运用能力,正确推断物质是解本题关键,涉及盐类水解、物质推断、热化学反应等知识点,难点是(3)题产物的确定.

 名校课堂系列答案
名校课堂系列答案| A. | Fe3+ | B. | Al3+ | C. | NH4+ | D. | Cl- |
| A. | 离子半径:F->Mg2+>Al3+ | B. | 热稳定性:HCl>H2S>AsH3 | ||
| C. | 酸性:H3AlO3<H2CO3<H3PO4 | D. | 水溶性:SO2<H2S<NH3 |
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| Ⅰ | 7.4 | 40.00 | 1.68 |
| Ⅱ | 14.8 | 40.00 | 3.36 |
| Ⅲ | 22.2 | 40.00 | 1.12 |
| Ⅳ | 37.0 | 40.00 | 0 |
(2)3.7g该样品进行同样实验时,生成的氨气在标准状况下体积为0.84L.
(3)试求算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比.
(4)欲计算该NaOH溶液的物质的量浓度应选择第Ⅲ组数据,并由此计算NaOH溶液的物质的量浓度,写出计算过程.
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 | |
| B. | 在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液 | |
| C. | 实验中需用2.0 mol•L-1的Na2 CO3溶液950 mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别为950mL,201.4g | |
| D. | 减压过滤的原理是抽气泵给吸滤瓶减压,造成吸滤瓶内与布氏漏斗液面上的压力差,从而加快过滤速度 |
①取少量样品加入足量冷的稀硫酸,有气泡产生,固体部分溶解
②另取少量样品加入足量浓盐酸并加热,有气泡产生,固体全部溶解
该黑色粉末可能为( )
| A. | Fe、MnO2 | B. | C、FeS | C. | Si、FeO | D. | CuO、Ag2S |
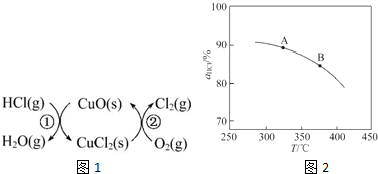
(1)传统上该转化通过如下所示的催化循环实现.其中,反应①为:2HCl(g)+CuO(s)?H2O(g)+CuCl2(s)△H1反应②生成1mol Cl2(g)的反应热为△H2,则总反应的热化学方程式为4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)△H=2(△H1+△H2)(反应热用△H1和△H2表示).
(2)新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性.
①实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的转化率αHCl~T曲线如图1:则总反应的△H<0(填“>”“=”或“<”);A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,画出相应αHCl~T曲线的示意图1
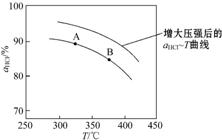 ,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.
,并简要说明理由:增大压强,平衡向正反应方向移动,αHCl增大,相同温度下HCl的平衡转化率比之前实验的大.③下列措施中,有利于提高αHCl的有BD.
A.增大n(HCl) B.增大n(O2) C.使用更好的催化剂 D.移去H2O
(3)一定条件下测得反应过程中n(Cl2)的数据如下:
| t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
(4)Cl2用途广泛,写出用Cl2制备漂白粉的化学反应方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
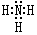 ;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.
;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式2Na+2NH3=2NaNH2+H2↑.