题目内容
下列反应中,反应物和产物的空间构型不会发生本质变化的是( )
A、CH4
| |||
B、CH2═CH2
| |||
C、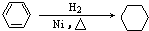 | |||
D、CH4
|
考点:有机物的结构和性质,常见有机化合物的结构,有机化学反应的综合应用
专题:有机反应
分析:A.甲烷、氯甲烷中C原子均为sp3杂化,为四面体构型;
B.乙烯中C原子为sp2杂化,生成物中C原子为sp3杂化;
C.苯为平面结构,C原子为sp3杂化,但环己烷中C原子为sp3杂化;
D.甲烷中C为sp3杂化,而二氧化碳中C原子为sp杂化.
B.乙烯中C原子为sp2杂化,生成物中C原子为sp3杂化;
C.苯为平面结构,C原子为sp3杂化,但环己烷中C原子为sp3杂化;
D.甲烷中C为sp3杂化,而二氧化碳中C原子为sp杂化.
解答:
解:A.甲烷、氯甲烷中C原子均为sp3杂化,为四面体构型,反应物和产物的空间构型不会发生本质变化,故A选;
B.乙烯中C原子为sp2杂化,生成物中C原子为sp3杂化,前者为平面结构,后者为四面体结构,故B不选;
C.苯为平面结构,C原子为sp3杂化,但环己烷中C原子为sp3杂化,前者为平面结构,后者为四面体结构,故C不选;
D.甲烷中C为sp3杂化,而二氧化碳中C原子为sp杂化,前者为四面体结构,后者为直线结构,故D不选;
故选A.
B.乙烯中C原子为sp2杂化,生成物中C原子为sp3杂化,前者为平面结构,后者为四面体结构,故B不选;
C.苯为平面结构,C原子为sp3杂化,但环己烷中C原子为sp3杂化,前者为平面结构,后者为四面体结构,故C不选;
D.甲烷中C为sp3杂化,而二氧化碳中C原子为sp杂化,前者为四面体结构,后者为直线结构,故D不选;
故选A.
点评:本题考查有机物的结构与性质,为高频考点,把握反应物、生成物中C原子的杂化方式为解答的关键,熟悉常见有机物空间构型即可解答,题目难度中等.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目
下列说法正确的是( )
| A、铜锌原电池工作时,若有6.5g锌被溶解,电路中就有0.1mol电子通过 |
| B、原电池装置中,电子从正极流向负极 |
| C、可利用CH4和O2的反应设计成原电池 |
| D、在周期表中金属和非金属的分界处易寻找到催化剂和耐高温、耐腐蚀的合金材料 |
设NA为阿佛加德罗常数,下列说法不正确的是( )
| A、18g水中含有的电子数为10NA |
| B、标准状态下,22.4L氦气中含NA个氦原子 |
| C、1molCl2与金属Na完全反应,可以得到2NA个电子 |
| D、在2mol/L的硝酸镁溶液中含有的硝酸根离子数位4NA |
下列离子方程式书写正确的是( )
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | ||||
B、往硫酸铝铵NH4Al(SO4)2溶液中滴加Ba(OH)2溶液并加热,刚好使NH4+全部转化为NH3:NH4++Al3++2SO42-+2Ba2++4OH-
| ||||
C、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| D、FeSO4溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+═Fe3++2H2O |
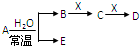 已知A、B、C、D、E、X是H、C、N、O、Na、Al、Cl、Fe等元素组成的常见单质或化合物,它们之间存在如图所示转化关系(部分生成物和反应条件已略去)
已知A、B、C、D、E、X是H、C、N、O、Na、Al、Cl、Fe等元素组成的常见单质或化合物,它们之间存在如图所示转化关系(部分生成物和反应条件已略去)下列说法正确的是( )
| A、若E为氧化物,则X一定为Fe |
| B、若E为氧化物,则在A与水的反应中,氧化剂和还原剂的质量比为1:2 |
| C、若E为单质气体,D为白色沉淀,B可能是共价化合物,也可能是离子化合物 |
| D、若B为单质气体,X可能为C、Na、N2+等 |
同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则下列判断中错误的是( )
| A、非金属性:X>Y>Z |
| B、X、Y、Z的最高价氧化物的水化物酸性由弱到强 |
| C、气体氢化物的稳定性,按X、Y、Z顺序递减 |
| D、X、Y、Z的最外层电子数依次减少 |
关于钠的叙述中,正确的是( )
| A、钠是银白色金属,硬度很大 |
| B、将金属钠放在坩埚里用酒精灯加热,生成淡黄色固体氧化钠 |
| C、金属钠在空气中燃烧,产生黄色火焰,生成过氧化钠 |
| D、金属钠的熔点很高 |
下列叙述正确的是( )
| A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
| B、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
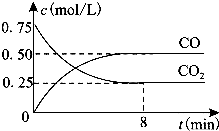 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.