题目内容
下列叙述正确的是( )
| A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
| B、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:A.电解池阴极上得电子发生还原反应;
B.电解饱和氯化钠反应方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,根据氢氧化钠和转移电子之间的关系式计算;
C.用惰性电极电解硫酸钠溶液反应方程式为2H2O
O2↑+2H2↑,阴极上生成氢气、阳极上生成氧气;
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
B.电解饱和氯化钠反应方程式为2NaCl+2H2O
| ||
C.用惰性电极电解硫酸钠溶液反应方程式为2H2O
| ||
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护.
解答:
解:A.原电池负极上金属失电子发生氧化反应,电解池阴极上得电子发生还原反应,故A错误;
B.电解饱和氯化钠反应方程式为2NaCl+2H2O
2NaOH+Cl2↑+H2↑,若有1mol电子转移,则生成0.5mol氯气生成,所以生成1molNaOH,故B正确;
C.用惰性电极电解硫酸钠溶液反应方程式为2H2O
O2↑+2H2↑,阴极上生成氢气、阳极上生成氧气,阴阳两极产物的物质的量之比为2:1,故C错误;
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,在镀锡铁板形成的原电池中铁作负极,加速被腐蚀,镀锌铁板形成的原电池中,锌作负极、铁作正极,铁被保护,所以镀锌铁板更耐腐蚀,故D错误;
故选B.
B.电解饱和氯化钠反应方程式为2NaCl+2H2O
| ||
C.用惰性电极电解硫酸钠溶液反应方程式为2H2O
| ||
D.作原电池负极的金属加速被腐蚀,作原电池正极的金属被保护,在镀锡铁板形成的原电池中铁作负极,加速被腐蚀,镀锌铁板形成的原电池中,锌作负极、铁作正极,铁被保护,所以镀锌铁板更耐腐蚀,故D错误;
故选B.
点评:本题考查了原电池和电解池原理,明确各个电极上发生的反应是解本题关键,再结合物质之间的关系式计算,题目难度不大.

练习册系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、少量CO2通入澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O |
| B、碳酸镁与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
| C、金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
| D、向小苏打溶液中加入盐酸溶液:HCO3-+H+=CO2↑+H2O |
下列反应中,反应物和产物的空间构型不会发生本质变化的是( )
A、CH4
| |||
B、CH2═CH2
| |||
C、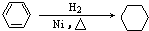 | |||
D、CH4
|
下列说法正确的是( )
| A、H2O和H2O2中的化学键类型完全相同 |
| B、N2的结构式为N-N |
| C、一个H2O分子所含的中子数为8(质量数:H-1,O-16) |
D、NaCl的电子式为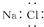 |
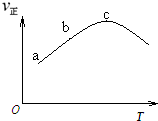 向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,反应过程中正反应速率随时间变化的示意图如图所示.下列说法正确的是( )
向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,反应过程中正反应速率随时间变化的示意图如图所示.下列说法正确的是( )| A、在平衡体系中再通入适量A(g),平衡正向移动,|△H|也增大 |
| B、反应在c点达到平衡 |
| C、反应物的浓度:a点小于b点 |
| D、反应达到平衡时,升高温度,A的转化率将减小 |
下列说法中正确的是( )
| A、醇在Cu或Ag的催化作用下都可以氧化成醛 |
B、有机物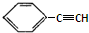 的所有原子一定处于同一平面上 的所有原子一定处于同一平面上 |
| C、醇都可以在浓H2SO4作用下以及170℃时发生消去反应 |
| D、分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |

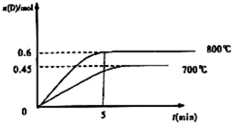 在容积为1L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
在容积为1L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题: