题目内容
设NA为阿佛加德罗常数,下列说法不正确的是( )
| A、18g水中含有的电子数为10NA |
| B、标准状态下,22.4L氦气中含NA个氦原子 |
| C、1molCl2与金属Na完全反应,可以得到2NA个电子 |
| D、在2mol/L的硝酸镁溶液中含有的硝酸根离子数位4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.水中含有10个电子,18g水的物质的量为1mol,含有10mol电子;
B.稀有气体为单原子分子,1mol氦气中含有1mol氦原子;
C.1mol氯气与钠完全反应生成2mol氯化钠,得到2mol电子;
D.题中缺少硝酸镁溶液的体积,无法计算溶液中硝酸根离子是数目.
B.稀有气体为单原子分子,1mol氦气中含有1mol氦原子;
C.1mol氯气与钠完全反应生成2mol氯化钠,得到2mol电子;
D.题中缺少硝酸镁溶液的体积,无法计算溶液中硝酸根离子是数目.
解答:
解:A.18g水的物质的量为1mol,1mol水中含有10mol电子,含有的电子数为10NA,故A正确;
B.标况下22.4L氦气的物质的量为1mol,1mol氦气中含有1mol氦原子,含NA个氦原子,故B正确;
C.1mol氯气与钠完全反应得到了2mol电子,得到2NA个电子,故C正确;
D.没有告诉硝酸镁溶液的体积,无法计算溶液中硝酸根离子的物质的量及数目,故D错误;
故选D.
B.标况下22.4L氦气的物质的量为1mol,1mol氦气中含有1mol氦原子,含NA个氦原子,故B正确;
C.1mol氯气与钠完全反应得到了2mol电子,得到2NA个电子,故C正确;
D.没有告诉硝酸镁溶液的体积,无法计算溶液中硝酸根离子的物质的量及数目,故D错误;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确稀有气体为单原子分子;要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
某单烯烃与H2 发生加成反应后得到的产物的结构简式如下:(CH3)2CH-CH2-C(CH3)3这种烯烃的结构式可能有几种( )
| A、3种 | B、5种 | C、6种 | D、7种 |
一定条件下,可逆反应N2+3H2?2NH3达到化学平衡状态,下列说法一定正确的是( )
| A、每1molN≡N断裂的同时有2 mol N-H生成 | ||
| B、N2、H2、NH3的浓度之比为1:3:2 | ||
| C、N2减少的速率和NH3减少的速率之比为1:2 | ||
D、气体体积为初始体积的
|
下列离子方程式书写不正确的是( )
| A、少量CO2通入澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O |
| B、碳酸镁与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
| C、金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
| D、向小苏打溶液中加入盐酸溶液:HCO3-+H+=CO2↑+H2O |
下列物质所属类别不正确的是( )
| A、纯碱;碱 |
| B、盐酸;无氧酸 |
| C、干冰;酸性氧化物 |
| D、碳酸氢钠;酸式盐 |
具有下列电子排布式的原子中,原子半径最大的是( )
| A、1s22s22p63s23p2 |
| B、1s22s22p63s2 |
| C、1s22s22p2 |
| D、1s22s22p63s23p4 |
下列反应中,反应物和产物的空间构型不会发生本质变化的是( )
A、CH4
| |||
B、CH2═CH2
| |||
C、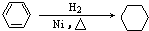 | |||
D、CH4
|