题目内容
下列离子方程式书写正确的是( )
| A、用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- | ||||
B、往硫酸铝铵NH4Al(SO4)2溶液中滴加Ba(OH)2溶液并加热,刚好使NH4+全部转化为NH3:NH4++Al3++2SO42-+2Ba2++4OH-
| ||||
C、用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-
| ||||
| D、FeSO4溶液与稀硫酸、双氧水混合:Fe2++H2O2+2H+═Fe3++2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.酸性溶液中氢离子与氢氧根离子反应生成水;
B.刚好使NH4+全部转化为NH3:硫酸铝铵NH4Al(SO4)2溶液中滴加Ba(OH)2溶液应按照物质的量之比1:2反应;
C.电荷不守恒,原子个数不守恒;
D.电荷不守恒.
B.刚好使NH4+全部转化为NH3:硫酸铝铵NH4Al(SO4)2溶液中滴加Ba(OH)2溶液应按照物质的量之比1:2反应;
C.电荷不守恒,原子个数不守恒;
D.电荷不守恒.
解答:
解:A.KIO3酸性溶液与KI反应的离子方程式:5I-+IO3-+6H+═3I2+3H2O,故A错误;
B.NH4Al(SO4)2溶液与Ba(OH)2溶液应按照物质的量之比1:2反应刚好使NH4+全部转化为NH3:NH4++Al3++2SO42-+2Ba2++4OH-
NH3↑+Al(OH)3↓+2BaSO4↓+H2O,故B正确;
C.浓盐酸与二氧化锰反应的离子方程式:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,故C错误;
D.FeSO4溶液与稀硫酸、双氧水反应的离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O,故D错误;
故选:B.
B.NH4Al(SO4)2溶液与Ba(OH)2溶液应按照物质的量之比1:2反应刚好使NH4+全部转化为NH3:NH4++Al3++2SO42-+2Ba2++4OH-
| ||
C.浓盐酸与二氧化锰反应的离子方程式:MnO2+4H++2Cl-
| ||
D.FeSO4溶液与稀硫酸、双氧水反应的离子方程式:2Fe2++H2O2+2H+═2Fe3++2H2O,故D错误;
故选:B.
点评:离子方程式的书写及正误判断是高考必考内容,把握离子方程式书写的方法,物质拆分的原子是解题的关键,判断离子方程式书写正误时,注意原子个数、电荷、得失电子守恒规律的应用.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
下列叙述中正确的是( )
| A、1mol任何纯净物都含有相同的原子数 |
| B、1mol O2中约含有6.02×1023个氧分子 |
| C、1mol氢中含有2mol氢原子和2mol电子 |
| D、1mol H2SO4中约含有6.02×1023个氢分子 |
下列离子方程式书写不正确的是( )
| A、少量CO2通入澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O |
| B、碳酸镁与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
| C、金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
| D、向小苏打溶液中加入盐酸溶液:HCO3-+H+=CO2↑+H2O |
具有下列电子排布式的原子中,原子半径最大的是( )
| A、1s22s22p63s23p2 |
| B、1s22s22p63s2 |
| C、1s22s22p2 |
| D、1s22s22p63s23p4 |
下列5种有机物:①2-甲基丙烷;②乙醇;③丙烷;④丁烷;⑤葡萄糖.按它们的沸点由高到低的顺序排列正确的是( )
| A、①②③④⑤ |
| B、⑤②④①③ |
| C、⑤④②①③ |
| D、③①②⑤④ |
下列反应中,反应物和产物的空间构型不会发生本质变化的是( )
A、CH4
| |||
B、CH2═CH2
| |||
C、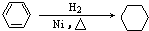 | |||
D、CH4
|
下列说法正确的是( )
| A、H2O和H2O2中的化学键类型完全相同 |
| B、N2的结构式为N-N |
| C、一个H2O分子所含的中子数为8(质量数:H-1,O-16) |
D、NaCl的电子式为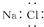 |