题目内容
关于钠的叙述中,正确的是( )
| A、钠是银白色金属,硬度很大 |
| B、将金属钠放在坩埚里用酒精灯加热,生成淡黄色固体氧化钠 |
| C、金属钠在空气中燃烧,产生黄色火焰,生成过氧化钠 |
| D、金属钠的熔点很高 |
考点:钠的化学性质
专题:几种重要的金属及其化合物
分析:A.金属钠的硬度小,可以切割;
B.钠燃烧的产物是淡黄色过氧化钠;
C.钠的熔点很低,钠燃烧的产物是淡黄色过氧化钠;
D.钠的熔点很低;
B.钠燃烧的产物是淡黄色过氧化钠;
C.钠的熔点很低,钠燃烧的产物是淡黄色过氧化钠;
D.钠的熔点很低;
解答:
解:A.钠是银白色金属,硬度小,可以切割,故A错误;
B.钠燃烧的产物是淡黄色过氧化钠,不是氧化钠,故B错误;
C.钠的熔点很低,加热时,金属钠先熔成闪亮的小球并剧烈燃烧,产生黄色火焰,生成淡黄色固体过氧化钠,故C正确;
D.钠是熔点很低的一种金属,钠和水反应放出的热量能使其熔化成小球,故D错误;
故选C.
B.钠燃烧的产物是淡黄色过氧化钠,不是氧化钠,故B错误;
C.钠的熔点很低,加热时,金属钠先熔成闪亮的小球并剧烈燃烧,产生黄色火焰,生成淡黄色固体过氧化钠,故C正确;
D.钠是熔点很低的一种金属,钠和水反应放出的热量能使其熔化成小球,故D错误;
故选C.
点评:本题考查金属钠的物理性质和化学性质,掌握钠的熔点低、硬度小、与氧气加热生成过氧化钠是解答的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
一定条件下,可逆反应N2+3H2?2NH3达到化学平衡状态,下列说法一定正确的是( )
| A、每1molN≡N断裂的同时有2 mol N-H生成 | ||
| B、N2、H2、NH3的浓度之比为1:3:2 | ||
| C、N2减少的速率和NH3减少的速率之比为1:2 | ||
D、气体体积为初始体积的
|
下列反应中,反应物和产物的空间构型不会发生本质变化的是( )
A、CH4
| |||
B、CH2═CH2
| |||
C、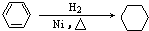 | |||
D、CH4
|
理论上不能用于设计成原电池的反应是( )
| A、2H2(g)+O2(g)=2H2O(l)△H<0 |
| B、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H<0 |
| C、4Fe(OH)2(s)+2H2O(l)+O2(g)=4 Fe(OH)3(s)△H<0 |
| D、HCl+NaOH=NaCl+H2O△H<0 |
下列说法正确的是( )
| A、H2O和H2O2中的化学键类型完全相同 |
| B、N2的结构式为N-N |
| C、一个H2O分子所含的中子数为8(质量数:H-1,O-16) |
D、NaCl的电子式为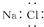 |
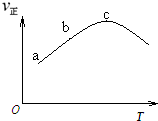 向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,反应过程中正反应速率随时间变化的示意图如图所示.下列说法正确的是( )
向绝热恒容密闭容器中只通入A(g)和B(g),在一定条件下使反应A(g)+B(g)?C(g)+D(g)△H=QkJ/mol达到平衡,反应过程中正反应速率随时间变化的示意图如图所示.下列说法正确的是( )| A、在平衡体系中再通入适量A(g),平衡正向移动,|△H|也增大 |
| B、反应在c点达到平衡 |
| C、反应物的浓度:a点小于b点 |
| D、反应达到平衡时,升高温度,A的转化率将减小 |

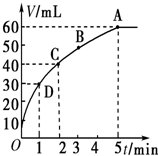 把0.01mol MnO2粉末加入50mL过氧化氢的溶液里,在标准状况下,放出气体的体积V和时间t的关系曲线如图所示.
把0.01mol MnO2粉末加入50mL过氧化氢的溶液里,在标准状况下,放出气体的体积V和时间t的关系曲线如图所示.