题目内容
下列说法正确的是( )
| A、铜锌原电池工作时,若有6.5g锌被溶解,电路中就有0.1mol电子通过 |
| B、原电池装置中,电子从正极流向负极 |
| C、可利用CH4和O2的反应设计成原电池 |
| D、在周期表中金属和非金属的分界处易寻找到催化剂和耐高温、耐腐蚀的合金材料 |
考点:原电池和电解池的工作原理,元素周期表的结构及其应用
专题:电化学专题
分析:A.铜锌原电池工作时,负极上发生的电极反应式为Zn-2e-=Zn2+,根据锌和转移电子之间的关系式计算;
B.原电池放电时,电子从负极流向正极;
C.自发进行的放热的氧化还原反应能设计成原电池;
D.在元素周期表中金属和非金属元素分界线处易找到半导体.
B.原电池放电时,电子从负极流向正极;
C.自发进行的放热的氧化还原反应能设计成原电池;
D.在元素周期表中金属和非金属元素分界线处易找到半导体.
解答:
解:A.n(Zn)=
=0.1mol,铜锌原电池工作时,负极上发生的电极反应式为Zn-2e-=Zn2+,所以若有6.5g锌被溶解,电路中就有0.2mol电子通过,故A错误;
B.原电池放电时,电子从负极流向正极,电流从正极流向负极,故B错误;
C.自发进行的放热的氧化还原反应能设计成原电池,甲烷和氧气能自发进行且为放热的氧化还原反应,所以能设计成燃料电池,故C正确;
D.在元素周期表中金属和非金属元素分界线处易找到半导体,在过渡元素中易寻找催化剂和耐高温、耐腐蚀的合金材料,故D错误;
故选C.
| 6.5g |
| 65g/mol |
B.原电池放电时,电子从负极流向正极,电流从正极流向负极,故B错误;
C.自发进行的放热的氧化还原反应能设计成原电池,甲烷和氧气能自发进行且为放热的氧化还原反应,所以能设计成燃料电池,故C正确;
D.在元素周期表中金属和非金属元素分界线处易找到半导体,在过渡元素中易寻找催化剂和耐高温、耐腐蚀的合金材料,故D错误;
故选C.
点评:本题考查了原电池原理和元素周期表的用途,知道原电池中电子的流向、原电池反应特点及元素周期表用途即可解答,为考试热点,题目难度不大.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
在强酸性和强碱性溶液中均不能大量共存的离子组是( )
| A、K+、Fe3+、SO42-、NO3- |
| B、K+、Na+、CO32-、OH- |
| C、Ca2+、Na+、NO3-、Cl- |
| D、Na+、Mg2+、CH3COO-、Cl- |
某单烯烃与H2 发生加成反应后得到的产物的结构简式如下:(CH3)2CH-CH2-C(CH3)3这种烯烃的结构式可能有几种( )
| A、3种 | B、5种 | C、6种 | D、7种 |
下列叙述中正确的是( )
| A、1mol任何纯净物都含有相同的原子数 |
| B、1mol O2中约含有6.02×1023个氧分子 |
| C、1mol氢中含有2mol氢原子和2mol电子 |
| D、1mol H2SO4中约含有6.02×1023个氢分子 |
在同温同压下,相同质量的下列气体中体积最大的是( )
| A、O2 |
| B、CH4 |
| C、N2 |
| D、CO2. |
下列判断错误的是( )
| A、酸性:HClO4>H2SO4>H3PO4 |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、沸点:I2>Br2>Cl2>F2 |
| D、沸点:HI>HBr>HCl>HF |
一定条件下,可逆反应N2+3H2?2NH3达到化学平衡状态,下列说法一定正确的是( )
| A、每1molN≡N断裂的同时有2 mol N-H生成 | ||
| B、N2、H2、NH3的浓度之比为1:3:2 | ||
| C、N2减少的速率和NH3减少的速率之比为1:2 | ||
D、气体体积为初始体积的
|
下列离子方程式书写不正确的是( )
| A、少量CO2通入澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O |
| B、碳酸镁与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑ |
| C、金属铝溶于盐酸中:Al+2H+=Al3++H2↑ |
| D、向小苏打溶液中加入盐酸溶液:HCO3-+H+=CO2↑+H2O |
下列反应中,反应物和产物的空间构型不会发生本质变化的是( )
A、CH4
| |||
B、CH2═CH2
| |||
C、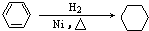 | |||
D、CH4
|