题目内容
2.电化学原理在化学工业中有广泛的应用.请根据如图回答问题: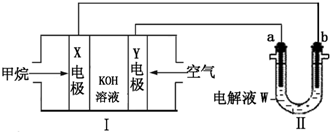
(1)装置Ⅰ中的X电极的名称是负极,Y电极的电极反应式为O2+2H2O+4e-=4OH-,工作一段时间后,电解液的pH将减小(填“增大”、“减小”或“不变”).
(2)若装置Ⅱ中a、b均为Pt电极,W为400mL滴有几滴酚酞的饱和NaCl溶液(电解前后溶液体积不变).
①实验开始后,观察到b电极周围溶液变红色,其原因是(用电极反应式表示)2H2O+2e-=H2↑+2OH-;检验a电极产物的方法是将湿润的淀粉碘化钾试纸放在a电极的出气口附近;
②常温下,当Y极反应消耗标准状况下的气体2.24L时,装置Ⅱ中得到溶液的pH为14.
(3)若利用装置Ⅱ进行铜的精炼,则a电极的材料为粗铜,工作一段时间后装置Ⅱ电解液中c(Cu2+)将减小(填“增大”、“减小”或“不变”).
(4)若装置Ⅱ为在铁棒上镀银的装置,电极a上发生的反应为Ag-e-═Ag+,电解池盛放的电解液W可以是AgNO3溶液.
分析 (1)装置Ⅰ为甲烷燃料电池,燃料在负极发生氧化反应,生成二氧化碳能够与KOH反应,导致溶液pH减小,氧气在正极发生还原反应,生成氢氧根离子;
(2)①根据图知,Y是正极,b是阳极,用惰性电极电解饱和食盐水时,阴极上氢离子放电生成氢气,同时生成了氢氧根离子,溶液滴有酚酞的溶液显示红色;阳极上氯离子失去电子生成氯气,氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色;
②Y电极的电极反应式为O2+2H2O+4e-=4OH-,2.24L气体为0.1mol,则转移电子为0.4mol,根据电子守恒计算装置II生成的氢氧根离子的物质的量,然后求出pH;
(3)铜的电解精炼中,粗铜接阳极,因为阳极上有比铜活泼的金属放电,导致铜离子浓度减小;
(4)电镀时,待镀金属为阴极,镀层金属为阳极,电解质溶液为含有镀层金属阳离子的溶液.
解答 解:(1)装置Ⅰ为甲烷燃料电池,燃料在负极发生氧化反应,生成二氧化碳能够与KOH反应,导致溶液pH减小,在碱性环境中,氧气在正极发生还原反应,生成氢氧根离子,电极反应式为:O2+2H2O+4e-=4OH-,
故答案为:负极;O2+2H2O+4e-=4OH-;减小;
(2)①电解饱和食盐水得到氢气、氯气和氢氧化钠,其离子方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,b是阴极,阴极上氢离子放电生成氢气,同时电极附近生成氢氧化钠,所以溶液碱性增强,酚酞试液遇碱变红色,电极反应式为:2H2O+2e-=H2↑+2OH-,氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验生成气体,
故答案为:2H2O+2e-=H2↑+2OH-;将湿润的淀粉碘化钾试纸放在a电极的出气口附近;
②Y电极的电极反应式为O2+2H2O+4e-=4OH-,2.24L气体为0.1mol,则转移电子为0.4mol,装置II中发生的反应为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,转移0.4mol电子时生成0.4mol氢氧根离子,则c(OH-)=1mol/L,所以溶液的pH为14;
故答案为:14;
(3)电镀法精炼铜时,粗铜为阳极,精铜为阴极,所以阳极材料是粗铜;阳极上失电子变成离子进入溶液,因作阳极的粗铜中的铜和比铜活泼的金属都失去电子进入溶液,阴极溶液中Cu2+得到电子沉积在阴极上,所以,为阳极a电极连接粗铜,电解一段时间后,溶液中铜离子浓度在减小,
故答案为:粗铜;减小;
(4)若装置Ⅱ为在铁棒上镀银的装置,则Fe为阴极,银为阳极,电解质溶液为硝酸银溶液,a与正极相连为阳极,银在阳极上失电子生成银离子,即Ag-e-═Ag+;
故答案为:Ag-e-═Ag+;AgNO3溶液.
点评 本题考查了原电池原理和电解原理的分析应用,主要是电极反应的书写和电子守恒的计算应用,掌握基础是关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

 小学教材完全解读系列答案
小学教材完全解读系列答案①Cl2(HCl):饱和食盐水、过滤 ②CO2(SO2):饱和Na2CO3溶液、洗气
③铁粉(铝粉):NaOH溶液、过滤 ④MnO2(KCl):水、溶解后过滤
⑤碳粉(碘单质):CCl4、分液 ⑥C2H5OH(H2O):加新制CaO后蒸馏.
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
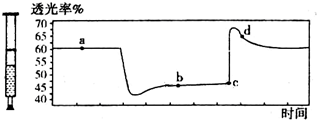 已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知2NO2═N2O4+Q (Q>0),将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | c点的操作是拉伸注射器 | |
| B. | b点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | 若反应在一绝热容器中进行,则a、b两点的平衡常数Ka>Kb | |
| D. | d点:v(正)>v(逆) |
| A. | 升高温度 | B. | 适当增大压强 | ||
| C. | 加入催化剂 | D. | 从容器中分离出氨 |
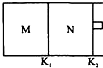 如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )
如图所示,隔板K1固定不动,活塞K2可自由移动.T℃时,M、N两个容器中均发生反应N2(g)+3H2(g)?2NH3(g),向容器M、N中各充入l mol N2和3mol H2,初始M、N的容积和温度相同,并保持温度不变.下列说法中不正确的是( )| A. | 反应达到平衡时N2的转化率:M<N | B. | H2的体积分数:M<N | ||
| C. | NH3的浓度:M<N | D. | 该反应在T℃时的平衡常数K:M=N |
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
| A. | 互为同位素的两种原子 | B. | 两种不同元素的原子 | ||
| C. | 一种原子和一种离子 | D. | 一种阴离子和一种阳离子 |
| A. | 铵态氮肥和草木灰?含K2CO3能混合施用 | |
| B. | 化肥和农家肥?如绿肥?不可混合施用 | |
| C. | “盐碱地”中有Na2CO3通过加石膏使之生成碳酸钙,这样根据平衡移动原理,随着c(CO32-)浓度的降低,“盐碱地”的碱性降低 | |
| D. | 复合肥?如磷酸氢二铵?和生石灰能一起施用 |