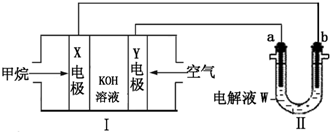
题目内容
10.在体积不变的密闭容器中按一定比例通入氮气和氢气,反应合成氨气,该反应放热.欲加快反应的速率同时提高合成氨中H2的转化率,下列措施可行的是( )| A. | 升高温度 | B. | 适当增大压强 | ||
| C. | 加入催化剂 | D. | 从容器中分离出氨 |
分析 根据影响化学反应速率、化学平衡的影响条件分析判断,升温、增大压强、加入催化剂、增大浓度都可以增大反应速率,平衡向正向进行,增大另一种物质的浓度会提高氢气转化率.
解答 解:N2+3H2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$2NH3,反应是气体体积减小的放热反应,平衡向正向进行,增大另一种物质的浓度会提高氢气转化率,升高温度、增大压强、增大浓度、加入催化剂会增大反应速率,
A.升温增大反应速率,反应是放热反应升温平衡逆向进行,氢气转化率减小,故A错误;
B.适当增大压强,反应速率增大,平衡向气体体积减小的方向进行,增大压强反应正向进行,氢气转化率增大,故B正确;
C.催化剂改变反应速率不改变化学平衡,氢气转化率不变,故C错误;
D.从容器中分离出氨,生成物浓度减小,反应速率减小,平衡正向进行,氢气转化率增大,故D错误;
故选B.
点评 本题考查了影响化学反应速率、化学平衡的因素的分析,化学平衡移动原理的应用是解题关键,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
16.下列单质或化合物性质的描述正确的是( )
| A. | 常温常压下,一氧化氮能与空气中的氧气直接化合 | |
| B. | SiO2与酸、碱均不反应 | |
| C. | Na2O、Na2O2组成元素相同,两化合物都为碱性氧化物 | |
| D. | NO2通入FeSO4溶液中始终无明显现象 |
1.某澄清溶液,可能含有NH4+、Na+、Cl-、CO32-、I-中的一种或几种,现做如下实验:
①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成
③用铂丝蘸取少量溶液做焰色反应实验,火焰的颜色呈黄色
④加入NaOH溶液并加热,没有任何现象
下列关于该澄清溶液的说法中错误的是( )
①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色
②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成
③用铂丝蘸取少量溶液做焰色反应实验,火焰的颜色呈黄色
④加入NaOH溶液并加热,没有任何现象
下列关于该澄清溶液的说法中错误的是( )
| A. | 一定含有I- | B. | 一定含有CO32- | C. | 一定含有NH4+ | D. | 一定含有Na+ |
18.下列说法不正确的是( )
| A. | 原电池外电路中电子由负极流向正极 | |
| B. | 原电池中发生还原反应的电极是正极 | |
| C. | 电解池中发生还原反应的电极是阳极 | |
| D. | 电解池中质量增加的电极是阴极 |
5.对于某些离子的检验及结论正确的是( )
| A. | 向某溶液中滴加NaOH溶液并加热,用湿润的蓝色石蕊试纸于试管口以检验NH4+ | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加入盐酸,沉淀不消失,一定有SO42- | |
| C. | 某待测液焰色反应呈黄色,则待测液中一定不含有K+ | |
| D. | 某溶液中加入KSCN后,溶液无变化,再加入H2O2后,溶液变成血红色,说明原溶液中一定含有Fe2+ |
19.下列化学用语书写正确的是 ( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 丙烯的键线式: | ||
| C. | 乙醇的结构式: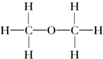 | D. | 甲烷的电子式: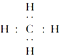 |
20.甲~辛等元素在周期表中的位置如下表所示.下列说法不正确的是( )
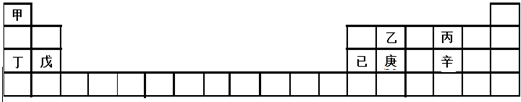

| A. | 乙、丙、辛都是非金属元素 | B. | 甲、丁、戊的单质都是金属 | ||
| C. | 乙、庚、辛都能形成氧化物 | D. | 己的氧化物可与氢氧化钠反应 |
 氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用.
氨和联氨(N2H4)是氮的两种常见化合物,在工农业生产中有重要的应用. [N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).
[N2H5•H2O]++H+.下列盐酸肼溶液中的离子浓度关系正确的是ac(填序号).