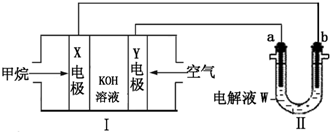
题目内容
8.欲除去下列物质中的杂质(括号内为杂质)所用试剂和操作方法都正确的是( )①Cl2(HCl):饱和食盐水、过滤 ②CO2(SO2):饱和Na2CO3溶液、洗气
③铁粉(铝粉):NaOH溶液、过滤 ④MnO2(KCl):水、溶解后过滤
⑤碳粉(碘单质):CCl4、分液 ⑥C2H5OH(H2O):加新制CaO后蒸馏.
| A. | ①②③ | B. | ③④⑥ | C. | ②④⑤ | D. | ①④⑤ |
分析 ①HCl极易溶于水,食盐水抑制氯气的溶解;
②二者均与亚硫酸钠溶液反应;
③Al与NaOH溶液反应,而Fe不能;
④KCl溶于水,而二氧化锰不溶于水;
⑤碘易溶于四氯化碳,碳不能;
⑥CaO与水反应后,增大与乙醇的沸点差异.
解答 解:①HCl极易溶于水,食盐水抑制氯气的溶解、则利用食盐水、洗气可除杂,故错误;
②二者均与亚硫酸钠溶液反应,不能除杂,应选饱和碳酸氢钠溶液、洗气,故错误;
③Al与NaOH溶液反应,而Fe不能,则NaOH溶液、过滤可除杂,故正确;
④KCl溶于水,而二氧化锰不溶于水,则溶解后过滤可除杂,故正确;
⑤碘易溶于四氯化碳,碳不能,应加四氯化碳、过滤,故错误;
⑥CaO与水反应后,增大与乙醇的沸点差异,然后蒸馏可除杂,故正确;
故选B.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
18.下列关于物质性质的说法不正确的是( )
| A. | HCl气体能使湿润的蓝色石蕊试纸变红 | |
| B. | 通常状况下,NO2是无色的气体 | |
| C. | 铝单质可与氢氧化钠溶液反应生成氢气 | |
| D. | 铁单质与浓硝酸加热时能发生反应 |
16.下列单质或化合物性质的描述正确的是( )
| A. | 常温常压下,一氧化氮能与空气中的氧气直接化合 | |
| B. | SiO2与酸、碱均不反应 | |
| C. | Na2O、Na2O2组成元素相同,两化合物都为碱性氧化物 | |
| D. | NO2通入FeSO4溶液中始终无明显现象 |
3.已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,则下列说法中一定正确的是( )
| A. | 在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-)+2c(H2B) | |
| B. | NaHB溶液可能存在以下关系:c(Na+)>c(HB-)>c(OH-)>c(H+) | |
| C. | NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) | |
| D. | NaHB溶液一定呈酸性,Na2B溶液一定呈碱性 |
13.下列有关化学用语使用错误的是( )
| A. | NaBr的电子式: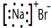 | B. | Na218O 中阴离子的结构示意图: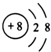 | ||
| C. | CH4的结构式: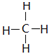 | D. | HF的电离方程式:HF?F-+H+ |
20.“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )
①是胶体 ②是溶液 ③能产生丁达尔效应
④不能透过滤纸 ⑤能透过滤纸 ⑥能透过半透膜.
①是胶体 ②是溶液 ③能产生丁达尔效应
④不能透过滤纸 ⑤能透过滤纸 ⑥能透过半透膜.
| A. | ①③⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③⑤⑥ |
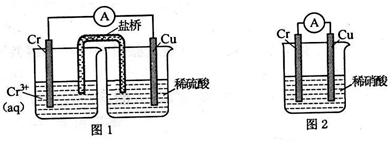 铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.
铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各 种性能的不锈钢,CrO3大量地用于电镀工业中.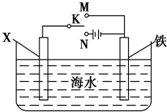 ,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.
,可以模拟铁的电化学防护.若 X 为碳棒,为减缓铁的腐蚀,开关 K 应置于N处.若 X 为锌,开关K 置于N或M处.