题目内容
4.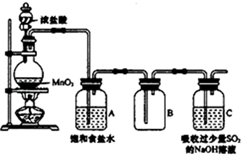 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
分析 (1)根据若装置的气密性良好,则在烧瓶受热后,气体膨胀,会导致C中有气泡冒出、冷却后气体收缩,则导管中会形成一段水柱来分析;
(2)根据仪器的结构来分析;根据用MnO2的浓盐酸制备Cl2的化学方程式来书写离子方程式;用此反应制取的氯气中混有大量的HCl,HCl极易溶于水,而氯气在水溶液中的溶解度本来就不大,NaCl的存在会降低氯气的溶解度;
(3)①根据反应原理:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可假设:1、溶液中可能存在只存在SO32,2、只存在ClO-;3:既不存在SO32-,也不存在ClO-;
②当吸收液中SO32的完全反应后,通入的氯气会与OH-反应;
③根据所限制实验试剂和SO32-、ClO-的性质,先加入硫酸至酸性,若存在SO32-或ClO-,分别生成了H2SO3和HClO;因为HClO具强氧化性,选择淀粉KI试液,证明有ClO-的存在;H2SO3具有还原性,选择具有强氧化性的高锰酸钾溶液,证明SO32-的存在.
解答 解:(1)根据若装置的气密性良好,则在烧瓶受热后,气体膨胀,会导致C中有气泡冒出、冷却后气体收缩,则导管中会形成一段水柱,故气密性的检查方法是:向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱,
故答案为:向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱;
(2)根据仪器的结构可知为分液漏斗;用MnO2的浓盐酸制备Cl2的化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,此反应中能拆的为HCl和MnCl2,故离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;盐酸是挥发性酸,浓盐酸在受热时极易挥发用,故用此反应制取的氯气中混有大量的HCl,而HCl极易溶于水,但氯气在水溶液中的溶解度本来就不大,NaCl的存在又会降低氯气的溶解度,故将制得的氯通过饱和食盐水可以除去其中的HCl,
故答案为:分液漏斗;MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;除去氯气中混有的HCl;
(3)①②由于通入氯气后首先发生反应:Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O,可提出以下假设:
假设1、当吸收液中SO32过量时,溶液中可能存在只存在SO32;
假设2、当氯气过量时,过量氯气会继续与OH-反应,溶液中可能只存在ClO-;
假设3、当通入的氯气和吸收液中SO32的恰好完全反应时,既不存在SO32-也不存在ClO-,
故答案为:①只存在SO32-;②Cl2+2OH-=Cl-+ClO-+H2O;
③因为吸收液呈碱性,先取少量吸收液于试管中,滴加3moL-L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中先加入硫酸的试管,若存在SO32-或ClO-,分别生成了H2SO3和HClO;
在A试管中滴加0.01mol•L-1KMnO4溶液,若紫红色褪去,证明有SO32-,即假设I成立;如果紫色不褪色,则无SO32-,即假设II或假设III成立;
在B试管中滴加淀粉KI溶液,若溶液变变蓝,证明有ClO-;如果不变蓝,则无ClO-,结合步骤2中的II,则假设3成立;
故答案为:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立 Ⅱ:若溶液紫红色不褪去,则假设2或3成立 |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立 Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立 |
点评 本题属于实验探究题,要根据实验原理提出假设,再结合物质的性质加以验证,如利用次氯酸的酸性和漂白性验证是否含有次氯酸根离子,利用亚硫酸的还原性验证是否含有亚硫酸根离子.

| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |

| A. | 1 mol莽草酸完全燃烧消耗156.8 L O2 | |
| B. | 1 mol莽草酸最多与4 mol Na发生反应 | |
| C. | 莽草酸能使溴的四氯化碳溶液褪色 | |
| D. | 莽草酸可发生聚合反应 |
| A. | 氧化物、氢化物都是只含二种元素 | |
| B. | 混合物中的元素一定是化合态的形式存在 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 由一种元素组成的物质一定是纯净物 |
| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| D. | 二氧化碳通入足量澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
| A. | pH=1的溶液中:K+、NO3-、SO32-、Na+ | |
| B. | 使石蕊呈红色的溶液中:Na+、HCO3-、NO3-、AlO2- | |
| C. | 使pH试纸显红色的溶液中:Cu2+、Fe3+、NO3-、SO42- | |
| D. | 在酸性溶液中:NH4+、Na+、Cu2+、ClO- |
| A. | 第一步 | B. | 第二步 | C. | 第三步 | D. | 第四步 |

| A. | 核磁共振谱 | B. | 质谱 | C. | 红外光谱 | D. | 紫外光谱 |