题目内容
9.下列离子方程式的书写正确的是( )| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| D. | 二氧化碳通入足量澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O |
分析 A.不符合反应客观事实;
B.漏掉氢离子与氢氧根离子的反应;
C.氢氧化钡过量反应生成碳酸钡、氢氧化钠和水;
D.氢氧化钙过量反应生成碳酸钙和水;
解答 解:A.铁和稀盐酸反应生成氯化亚铁和氢气,离子方程式:Fe+2H+═Fe2++H2↑,故A错误;
B.氢氧化钡溶液滴入硫酸中反应生成硫酸钡和水,离子方程式:Ba2++SO42-+2OH-+2H+═2H2O+BaSO4↓,故B错误;
C.向NaHCO3溶液中加入足量的Ba(OH)2溶液:Ba2++HCO3-+OH-=BaCO3↓+H2O,故C错误;
D.二氧化碳通入足量澄清石灰水中,离子方程式:CO2+Ca2++2OH-═CaCO3↓+H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重考查复分解反应离子方程式书写,明确相关物质的性质及发生反应实质是解题关键,注意反应物用量对反应的影响,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
20. 如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
 如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | Ca (OH) 2悬浊液 |
17.下列各组离子在无色溶液中能够大量共存的是( )
| A. | NH4+、NO3-、Na+、SO42- | B. | H+、Fe3+、Na+、NO3- | ||
| C. | Ba2+、K+、Al3+、HCO3- | D. | NH4+、Li+、OH-、SO42- |
4.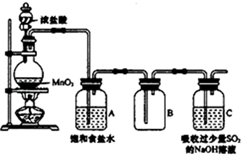 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
14.X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其他产物已略去):

下列说法不正确的是( )

下列说法不正确的是( )
| A. | 若W是单质铁,则Z溶液可能是FeCl2溶液 | |
| B. | 若W是盐酸,则X与Z可反应生成Y | |
| C. | 若X是FeCl3溶液,则W可以是Zn或Al | |
| D. | 若W是硝酸溶液,则X与Z不能反应生成Y |
1. 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )| A. | ① | B. | ①③ | C. | ①③⑤ | D. | ④⑤⑥ |
19.下列溶液中阴离子浓度最大的是( )
| A. | 0.5 mol•L-1HNO3溶液50mL | B. | 0.6mol•L-1A12(SO4)3溶液35 mL | ||
| C. | 1.8mol•L-1NaCl溶液70ml | D. | 0.7mol•L-1 FeC13溶液60 mL |
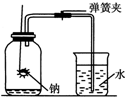 某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.