题目内容
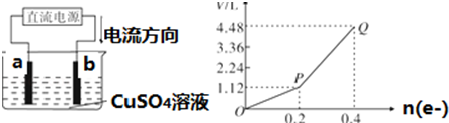
14.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,7.5mol CuSO4可氧化磷原子的物质的量为( )| A. | 1.5 mol | B. | 3 mol | C. | 5 mol | D. | 6 mol |
分析 该反应中P元素化合价由0价变为+5价、-3价,Cu元素化合价由+2价变为+1价,假设有15molCuSO4参加反应,根据转移电子相等计算可氧化P的物质的量.
解答 解:该反应中P元素化合价由0价变为+5价、-3价,Cu元素化合价由+2价变为+1价,假设有15molCuSO4参加反应,根据转移电子相等得被氧化n(P)=$\frac{15mol×(2-1)}{5-0}$=3mol,则7.5mol CuSO4可氧化磷原子的物质的量为1.5mol
故选A.
点评 本题考查氧化还原反应有关计算,为高频考点,明确该反应中P的性质是解本题关键,结合转移电子守恒分析解答,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
2.下列物质中,物质的量最多的是( )
| A. | 含3.01×1023个氮原子的N2 | B. | 标准状况下11.2 L H2 | ||
| C. | 1 mol Na2SO4中的Na+ | D. | 常温常压下32 g O2 |
3.化学与生活息息相关.下列说法正确的是( )
| A. | 矿泉水中不含任何化学物质 | |
| B. | 聚乙烯塑料薄膜可用作食品包装袋 | |
| C. | 碳酸钡可用作医疗上的“钡餐” | |
| D. | 氢氧化钠可用作治疗胃酸过多的药物 |
4.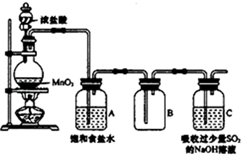 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
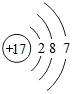 ,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
,可以证明该结论的实验是(用离子方程式表示)Cl2+S2-=2Cl-+S↓.
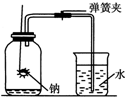 某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.
某班同学用如下图所示装置测定空气里氧气的含量.先用弹簧夹夹住橡胶管.点燃钠,伸入瓶中并塞上瓶塞.待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.