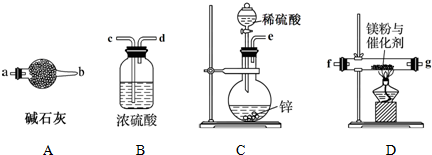
题目内容
14.TBC的一种标准谱图如图所示,它是( )
| A. | 核磁共振谱 | B. | 质谱 | C. | 红外光谱 | D. | 紫外光谱 |
分析 图中横坐标为单位cm的波数,为红外光谱,可用于测定有机物的官能团和共价键,以此解答该题.
解答 解:A.核磁共振谱用于测定H原子的种类和数目,与图无关,故A不选;
B.质谱图用于测定有机物的相对分子质量,与图无关,故B不选;
C.图中横坐标为单位cm的波数,为红外光谱,故C选;
D.紫外光谱横坐标为波长,与题不符,故D不选.
故选A.
点评 本题考查有机物的结构的测定,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构、组成的判断方法,难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
4.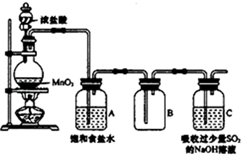 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
5.分析以下几个热化学方程式,哪个是表示固态碳或气态氢气燃烧时的燃烧热的是( )
| A. | C (s)+O2(g)=CO (g)△H=-110.5 kJ/mol | |
| B. | C (s)+O 2(g)=CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H=-241.8 kJ/mol |
2.下列离子方程式与所述事实相符且正确的是( )
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |
19.下列溶液中阴离子浓度最大的是( )
| A. | 0.5 mol•L-1HNO3溶液50mL | B. | 0.6mol•L-1A12(SO4)3溶液35 mL | ||
| C. | 1.8mol•L-1NaCl溶液70ml | D. | 0.7mol•L-1 FeC13溶液60 mL |
6.现有几种元素的性质或原子结构如表:
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是14C.
(2)画出T离子的结构示意图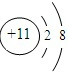 .
.
(3)写出工业上制取单质Z的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.若忽略100mL溶液反应一段时间后的体积变化,Z离子浓度由8mol/L变为6mol/L,求这段时间生成气体标况下的总体积为4.48L.
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
(2)画出T离子的结构示意图
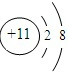 .
.(3)写出工业上制取单质Z的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑.若忽略100mL溶液反应一段时间后的体积变化,Z离子浓度由8mol/L变为6mol/L,求这段时间生成气体标况下的总体积为4.48L.
8.下列有关热化学方程式描述正确的是( )
| A. | 常温下,反应C(s)+CO2(g)?2CO(g)△H=a kJ/mol不能自发进行,则该反应的a<0 | |
| B. | 已知中和热△H为-57.3kJ/mol,则稀醋酸与0.1 mol/L NaOH溶液反应的热化学方程式为H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热△H为-241.8 kJ/mol | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成17.6g硫化亚铁时,放出19.12kJ热量.该反应的热化学方程式可表示为Fe(s)+S(s)═FeS(s)△H=-95.6 kJ/mol |