题目内容
13.在进行钠的性质的实验时,小明同学根据钠所属的物质类别即金属来推测钠可能与初中所学习的铁具有相似的化学性质,小明根据物质所属类别预测物质的性质属于研究物质性质的哪一步( )| A. | 第一步 | B. | 第二步 | C. | 第三步 | D. | 第四步 |
分析 对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论,以此解答该题.
解答 解:对物质性质进行研究的基本程序是:观察物质的外观性质→预测物质性质→设计实验→观察实验现象→对实验现象进行分析、解释→得出结论,预测物质性质属于第二步,
故选B.
点评 本题考查物质的检验方法,为高频考点,侧重于学生的分析、实验能力的考查,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.化学与生活息息相关.下列说法正确的是( )
| A. | 矿泉水中不含任何化学物质 | |
| B. | 聚乙烯塑料薄膜可用作食品包装袋 | |
| C. | 碳酸钡可用作医疗上的“钡餐” | |
| D. | 氢氧化钠可用作治疗胃酸过多的药物 |
4.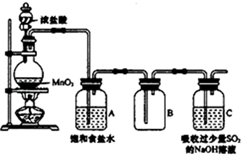 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:(1)装置连接好后,应先检查装置气密性,方法是向C中加水至淹没长导管,微热圆底烧瓶,观察C中长导管是否有气泡冒出,冷却后是否形成一段水柱.
(2)盛浓盐酸的仪器名称是分液漏斗;圆底烧瓶中发生反应的离子方程式是MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O;饱和食盐水的作用是除去氯气中混有的HCl.
(3)吸收Cl2时首先发生的反应时Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O.吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、SO42-和OH-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中CO2的影响).
①提出合理假设:
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-,也不存在ClO-;
②吸收液中可能存在ClO-的原因是Cl2+2OH-=Cl-+ClO-+H2O(用离子方程式表示).
③设计实验方案,进行实验.请在表中补充实验步骤以及预期现象和结论.限选实验试剂:3mol/L H2SO4溶液,1mol/L NaOH溶液、0.01mol/L KMnO4溶液、品红溶液、淀粉KI溶液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
1. 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
 某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )
某溶液含有Na+、K+、①Cl-、②SO32-、③SO42-、④I-、⑤NO3-、⑥CO32-八种离子.向其中加入少量浓硝酸后,溶液中离子浓度基本保持不变的是(溶液体积变化忽略不计)( )| A. | ① | B. | ①③ | C. | ①③⑤ | D. | ④⑤⑥ |
8.已知1g氧气含有m个分子,则阿伏加德罗常数为( )
| A. | $\frac{m}{32}$ mol-1 | B. | 16m mol-1 | C. | m mol-1 | D. | 32m mol-1 |
5.分析以下几个热化学方程式,哪个是表示固态碳或气态氢气燃烧时的燃烧热的是( )
| A. | C (s)+O2(g)=CO (g)△H=-110.5 kJ/mol | |
| B. | C (s)+O 2(g)=CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H=-241.8 kJ/mol |
2.下列离子方程式与所述事实相符且正确的是( )
| A. | 0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| B. | 向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O | |
| C. | 向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | 向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):3OH-+2CO2═CO32-+HCO3-+H2O |

