题目内容
与100mL 0.1mol/L AlCl3溶液中Cl-离子浓度相同的是( )
| A、10 mL 1 mol/L FeCl3溶液 |
| B、50 mL 0.3 mol/L NaCl溶液 |
| C、10 mL 0.2 mol/L CaCl2溶液 |
| D、200 mL 0.1 mol/L NH4Cl溶液 |
考点:物质的量浓度的相关计算
专题:
分析:100mL 0.1mol?L-1AlCl3溶液中Cl-物质的量浓度是0.3mol/L,离子浓度与溶液体积大小无关,与溶质浓度、化学式组成有关,据此对各选项进行判断.
解答:
解:A.10 mL 1 mol/L FeCl3溶液中氯离子浓度为:1mol/L×3=3mol/L,故A错误;
B.50mL 0.3mol/L的氯化钠溶液中氯离子浓度为0.3mol/L,故B正确;
C.10 mL 0.2 mol/L CaCl2溶液中氯离子浓度为:0.2mol/L×2=0.4mol/L,故C错误;
D.200mL 0.1 mol/L NH4Cl溶液中氯离子浓度为0.1mol/L,故D错误;
故选B.
B.50mL 0.3mol/L的氯化钠溶液中氯离子浓度为0.3mol/L,故B正确;
C.10 mL 0.2 mol/L CaCl2溶液中氯离子浓度为:0.2mol/L×2=0.4mol/L,故C错误;
D.200mL 0.1 mol/L NH4Cl溶液中氯离子浓度为0.1mol/L,故D错误;
故选B.
点评:本题考查物质的量浓度的计算,为高频考点,题目难度不大,试题侧重于学生的计算能力的考查,本题注意把握有关公式的运用,明确计算的是物质的量浓度还是物质的量,为易错点.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列有关物质的检验方法和结论都正确的是( )
| A、经点燃,产生蓝色火焰的气体一定是一氧化碳 |
| B、向某无色溶液中滴入酚酞试液,溶液变红色,该溶液一定是碱溶液 |
| C、向某无色溶液中滴入盐酸,无明显现象,再滴入氯化钡溶液,产生白色沉淀,该溶液中一定含有硫酸根离子 |
| D、把燃着的木条伸入某无色气体中,木条熄灭,该气体一定是二氧化碳 |
下列叙述正确的是( )
| A、Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B、漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C、将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D、向FeCl2溶液中通入Cl2反应的离子方程式为:Fe2++Cl2═Fe3++2C1- |
分类法在化学的发展中起到了重要作用,下列有关分类标准的叙述合理的是( )
| A、根据化学反应中的热效应将化学反应分为放热反应和吸热反应 |
| B、根据水溶液能否导电将化合物分为电解质和非电解质 |
| C、根据氧化物的组成将氧化物分为酸性氧化物、碱性氧化物和两性氧化物 |
| D、根据分散质和分散剂的聚集状态将分散系为浊液、胶体和溶液 |
以下现象与电化学腐蚀有关的是( )
| A、炒菜的铁锅容易生锈 |
| B、生铁比纯铁容易生锈 |
| C、运输石油的管道表面变暗 |
| D、银质奖牌(纯银制成)久置后表面变暗 |
对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H=?的化学反应,下列叙述不正确的是( )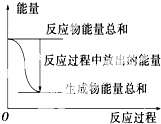

| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
在a L Fe2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量强碱并加热可得到c mol NH3,则原溶液中Fe3+的浓度(mol?L-1)为( )
A、
| ||
B、
| ||
C、
| ||
D、
|