题目内容
对于常温下0.1mol?L-1氨水和0.1mol?L-1醋酸,下列说法正确的是( )
| A、0.1 mol?L-1氨水,溶液的pH<13 |
| B、0.1 mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1 mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1 mol?L-1醋酸与0.1 mol?L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A.一水合氨是弱电解质,在水溶液里部分电离;
B.加水稀释促进一水合氨电离,但溶液中氢氧根离子浓度减小,温度不变,水的离子积常数不变,据此判断氢离子浓度;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断.
B.加水稀释促进一水合氨电离,但溶液中氢氧根离子浓度减小,温度不变,水的离子积常数不变,据此判断氢离子浓度;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
D.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断.
解答:
解:A.一水合氨是弱电解质,在水溶液里部分电离,所以氨水溶液中存在一水合氨电离平衡,则0.1mol?L-1氨水,溶液的pH<13,故A正确;
B.加水稀释促进一水合氨电离,氢氧根离子增多个数小于溶液体积增大倍数,所以溶液中氢氧根离子浓度减小,温度不变,水的离子积常数不变,则氢离子浓度增大,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-),故C错误;
D.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐,其溶液呈碱性c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO-),盐类水解较微弱,所以c(CH3COO-)>c(OH-),该溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选AD.
B.加水稀释促进一水合氨电离,氢氧根离子增多个数小于溶液体积增大倍数,所以溶液中氢氧根离子浓度减小,温度不变,水的离子积常数不变,则氢离子浓度增大,故B错误;
C.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(H+)=c(CH3COO-)+c(OH-),故C错误;
D.等物质的量的醋酸和氢氧化钠混合,二者恰好反应生成醋酸钠,醋酸钠为强碱弱酸盐,其溶液呈碱性c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CH3COO-),盐类水解较微弱,所以c(CH3COO-)>c(OH-),该溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D正确;
故选AD.
点评:本题考查了弱电解质的电离及盐类水解,常常与离子浓度大小比较联系考查,根据弱电解质电离特点及电荷守恒解答,易错选项是B,注意稀释氨水时,氨水溶液中只有氢离子浓度增大,为易错点.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案
相关题目
下列有关物质的检验方法和结论都正确的是( )
| A、经点燃,产生蓝色火焰的气体一定是一氧化碳 |
| B、向某无色溶液中滴入酚酞试液,溶液变红色,该溶液一定是碱溶液 |
| C、向某无色溶液中滴入盐酸,无明显现象,再滴入氯化钡溶液,产生白色沉淀,该溶液中一定含有硫酸根离子 |
| D、把燃着的木条伸入某无色气体中,木条熄灭,该气体一定是二氧化碳 |
下列有关的计算分析不正确的是( )
A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为
| ||
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol | ||
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为a=4b+3c | ||
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
下列有关试剂的保存方法,不正确的是( )
| A、浓硝酸保存在无色玻璃瓶中 |
| B、少量金属钠可保存在煤油里 |
| C、新制氯水保存在棕色试剂瓶中 |
| D、少量液溴可加水水封,并放置于阴凉处 |
对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H=?的化学反应,下列叙述不正确的是( )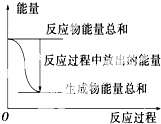

| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
