题目内容
下列反应属于氧化还原反应的是( )
| A、CaCO3+2HCl=CaCl2+CO2↑+H2O | ||||
| B、CaO+H2O=Ca(OH)2 | ||||
C、CaCO3
| ||||
| D、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O |
考点:氧化还原反应
专题:
分析:属于氧化还原反应,说明反应中有电子转移,其特征是有元素化合价升降,据此分析解答.
解答:
解:A.该反应中所有元素化合价不变,所以不属于氧化还原反应,属于复分解反应,故A错误;
B.该反应中所有元素化合价不变,所以不属于氧化还原反应,属于化合反应,故B错误;
C.该反应中所有元素化合价不变,所以不属于氧化还原反应,属于分解反应,故C错误;
D.该反应中Cu元素化合价由0价变为+2价、N元素化合价由+5价变为+2价,所以属于氧化还原反应,故D正确;
故选D.
B.该反应中所有元素化合价不变,所以不属于氧化还原反应,属于化合反应,故B错误;
C.该反应中所有元素化合价不变,所以不属于氧化还原反应,属于分解反应,故C错误;
D.该反应中Cu元素化合价由0价变为+2价、N元素化合价由+5价变为+2价,所以属于氧化还原反应,故D正确;
故选D.
点评:本题考查氧化还原反应,侧重考查基本概念,明确元素化合价即可解答,知道常见元素化合价,题目难度不大.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
下列有关的计算分析不正确的是( )
A、在反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,当有1 mol铜被氧化时,被还原的硝酸为
| ||
| B、某溶液100 mL,其中含硫酸0.03 mol,硝酸0.04 mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015 mol | ||
| C、室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系为a=4b+3c | ||
| D、物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比为1:4 |
下列叙述正确的是( )
| A、Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 |
| B、漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同 |
| C、将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀 |
| D、向FeCl2溶液中通入Cl2反应的离子方程式为:Fe2++Cl2═Fe3++2C1- |
以下现象与电化学腐蚀有关的是( )
| A、炒菜的铁锅容易生锈 |
| B、生铁比纯铁容易生锈 |
| C、运输石油的管道表面变暗 |
| D、银质奖牌(纯银制成)久置后表面变暗 |
对于Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H=?的化学反应,下列叙述不正确的是( )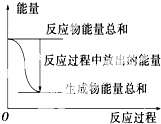

| A、反应过程中能量关系如上图表示,则该反应为放热反应 |
| B、若将其设计为原电池,当有32.5 g锌溶解时,正极放出气体一定为11.2 L |
| C、化学反应的焓变与反应方程式的计量数有关 |
| D、若将该反应设计成原电池,锌为负极 |
有关下列说法错误的是( )
| A、工厂里采用静电除尘,是利用了胶体电泳的性质 |
| B、根据物质在水中或熔融状态下是否导电,可将其分为电解质和非电解质 |
| C、分析和实验也是研究物质性质的方法 |
| D、电解质在水溶液中的反应实质是离子间的反应 |
在a L Fe2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-完全沉淀;若加入足量强碱并加热可得到c mol NH3,则原溶液中Fe3+的浓度(mol?L-1)为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,1 NA 个CO2分子占有的体积为22.4 L |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为1NA |
稀释某弱酸HA溶液时,浓度增大的是( )
| A、HA |
| B、H+ |
| C、A- |
| D、OH- |