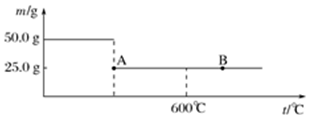
题目内容
6.将二氧化硫通入到氯化钡溶液中未见到明显现象,把上述溶液分为两份,其中一份a加入NaOH溶液,另一份b中通入Cl2,均有白色沉淀产生,其中a中沉淀的化学式为BaSO3,b中沉淀的化学式为BaSO4.分析 氢氧化钠和二氧化硫反应生成亚硫酸钠,亚硫酸钠和氯化钡反应生成亚硫酸钡沉淀;氯气能二氧化硫氧化生成硫酸,硫酸和氯化钡反应生成硫酸钡沉淀.
解答 解:SO2+2NaOH=Na2SO3+H2O、Na2SO3+BaCl2=2NaCl+BaSO3↓,所以a中沉淀是BaSO3;
SO2+Cl2+2H2O=H2SO4+2HCl、H2SO4+BaCl2=2HCl+BaSO4↓,所以b中沉淀是BaSO4;
故答案为:BaSO3、BaSO4.
点评 本题考查了二氧化硫的性质分析,主要是二氧化硫的还原性和酸性氧化物性质的理解应用,题目较简单.

练习册系列答案
相关题目
16. 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 该反应进行到M点放出的热量大于进行到W点放出的热量 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$ mol•L-1•min-1 | |
| C. | M点的正反应速率v正大于N点的逆反应速率v逆 | |
| D. | M点的正反应速率小于W点的逆反应速率 |
1.可以用来除去乙烷中混有少量乙烯的操作方法是( )
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛水的洗气瓶 | |
| D. | 混合气体与氢气混合 |
11.下列有机物分子中,所有原子不可能处于同一平面的是( )
| A. |  CH=CH2 CH=CH2 | B. | CH2=CH-CN | C. | CH2=CH-C(CH3)=CH2 | D. | CH2=CH-CH=CH2 |
18.在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g)═C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强 | B. | 气体的总体积 | ||
| C. | 混合气体的相对分子质量 | D. | 气体的总物质的量 |
15.如图图象中,纵坐标为沉淀物的物质的悬,横坐标为向溶液中加入反应物的物质的量,则相应的图象序号与(1)-(4)对应的是BCAD


| 溶液 | 加入物质 | 对应的图象 |
| (1)饱和石灰水 | 通过量CO2气体 | |
| (2)氯化铝溶液 | 加入过量氨水 | |
| (3)MgCl2、AICl3的混合液 | 逐滴加入NaOH溶液至过量 | |
| (4)含少量NaOH的NaAlO2溶液 | 逐滴加入稀盐酸 |
16.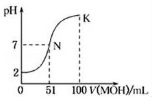 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+) |
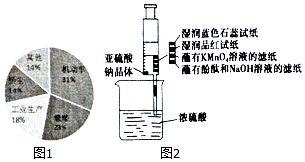 晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.
晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.