题目内容
17.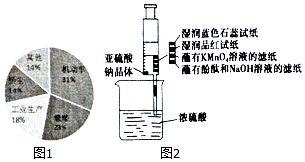 晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.
晋中市气象台2017年1月7日11时35分发布了雾霾黄色预警,随后晋中市发布了机动车限行通告.通过调查发现,形成雾霾的污染来源如图1所示.主要是机动车排放物和燃煤废气,其中会有大量的NOx和SO2.(1)下列反应不属于氮的固定过程的是CD
A.N2和H2在一定条件下反应生成NH3
B.豆科植物根瘤中的作用
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
E.雷雨闪电时空气中的N2和O2化合生成NO
(2)NOx能形成酸雨,写出NO2转化为HNO3的离子方程式:3NO2+H2O═2H++2NO3-+NO.
(3)汽车尾气中的NO和CO,其治理的一种方法是:在汽车的排气管上装一个催化转化装置,使这两种气体转化成无毒气体,反应的化学方程式为2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2.
(4)如图2所示,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准),研究SO2的化学性质,下列说法中正确的是BC
A.蓝色石蕊试纸先变红后褪色
B.品红试纸褪色,证明了SO2的漂白性
C.蘸有KMnO4溶液的滤纸褪色,证明了SO2的还原性
D.蘸有酚酞和NaOH溶液的滤纸褪色,证明了SO2的漂白性
(5)某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,原因是SO2溶于水生成亚硫酸,亚硫酸被空气中的氧气氧化为强酸硫酸.
(6)如何综合防治雾霾,请你写出两条建议:使用清洁能源、工业废气经处理后再排放.
分析 (1)氮的固定是指:将空气中游离态的氮转化为含氮化合物的过程.游离态是指氮气单质.氮的固定有:人工固氮和天然固氮;
(2)二氧化氮和水反应生成硝酸和一氧化氮;
(3)NO和CO反应生成N2和CO2;
(4)在注射器中加入少量Na2SO3,晶体,并吸入少量的浓硫酸,两者反应生成SO2;
A.SO2溶于水生成亚硫酸,溶液呈酸性,但SO2不能使指示剂褪色;
B.SO2具有漂白性,能使品红溶液褪色;
C.SO2具有还原性,与具有强氧化性的KMnO4发生氧化还原反应;
D.SO2为酸性气体,可与NaOH溶液反应生成盐和水,溶液碱性减弱.
(5)每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,是因为亚硫酸被空气中的氧气氧化为硫酸,酸性增强;
(6)为了防治雾霾,可从能源的污染方面和粉尘处理方面进行分析回答.
解答 解:(1)氮的固定是将空气中游离态的氮转化为含氮化合物的过程.
A.N2和H2在一定条件下反应生成NH3,属于工业固氮,故A不选;
B.大豆根瘤菌将N2转化成化合态氮,属于生物固氮,故B不选;
C.NH3经过催化氧化生成NO,都为氮的化合物,它们间的相互转化,属于化合物间的转化,不符合单质转化为化合物的特点,所以不属于氮的固定,故C选;
D.NH3和HNO3反应生成NH4NO3,都为氮的化合物,它们间的相互转化,属于化合物间的转化,不符合单质转化为化合物的特点,所以不属于氮的固定,故D选;
E.雷雨天:N2+O2═2NO,将氮气单质变为化合物中的氮元素,属于大气固氮,故E不选;
故答案为:CD;
(2)NOx能形成酸雨,NO2转化为HNO3反应3NO2+H2O═2HNO3+NO,离子方程式为:3NO2+H2O═2H++2NO3-+NO,
故答案为:3NO2+H2O═2H++2NO3-+NO;
(3)在汽车的排气管上装一个催化转化装置,NO和CO反应生成N2和CO2,反应的化学方程式为:2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{催化剂}}{△}$N2+2CO2;
(4)A.SO2只能使酸碱指示剂变色,所以湿润的蓝色石蕊试纸只变红,故A错误;
B.湿润品红试纸褪色,表现出SO2的漂白性,故B正确;
C.SO2具有还原性,与具有强氧化性的KMnO4发生氧化还原反应,KMnO4溶液的滤纸褪色,故C正确;
D.SO2为酸性气体,可与NaOH溶液反应生成盐和水,溶液碱性减弱,红色褪去,没有体现SO2的漂白性,故D错误;
故答案为:BC;
(5)酸雨的pH呈减小趋势,是因为SO2溶于水生成亚硫酸,亚硫酸被空气中的氧气氧化为硫酸,酸性增强,反应的离子方程式为:2H2SO3+O2═4H++2SO42-,
故答案为:SO2溶于水生成亚硫酸,亚硫酸被空气中的氧气氧化为强酸硫酸;
(6)化石燃料的燃烧产生了大量污染空气的粉尘,我们可以少使用化石燃料,该使用清洁能源;工业产生的粉尘经处理以后再排放以避免污染空气.
故答案为:使用清洁能源、工业废气经处理后再排放.
点评 本题考查硫、氮及其化合物的性质,熟练掌握元素化合物性质是解答关键,题目难度中等.

 快捷英语周周练系列答案
快捷英语周周练系列答案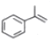 (异丙烯苯)$→_{一定条件}^{+H_{2}}$
(异丙烯苯)$→_{一定条件}^{+H_{2}}$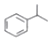 (异丙苯),下列说法错误的是( )
(异丙苯),下列说法错误的是( )| A. | 反应属于加成反应 | B. | 异丙苯的一氯代物共有6种 | ||
| C. | 可用溴水鉴别异丙烯苯和异丙苯 | D. | 异丙苯是苯的同系物 |

| A. | 回收碘的四氯化碳溶液中的四氯化碳,选① | |
| B. | 用酒精提取碘水中的碘,选③ | |
| C. | 将HCl气体从长导管通入并用水吸收,选⑤ | |
| D. | 粗盐提纯,选①和② |
| A. | NaClO | B. | NH4Cl | C. | CuSO4 | D. | HNO3 |
| A. | 1-丁醇的结构简式可写作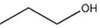 | |
| B. | 氨基酸合成多肽链属于加聚反应 | |
| C. | 分子式为C4H8O2,既含有羟基又含有醛基的同分异构体有5种 | |
| D. | 糖、油脂、蛋白质等这些人体必需的营养物质都是高分子化合物 |
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
②25℃时,将20mL 0.1mol•L-1 CH3COOH溶液和20mL 0.1mol•L-1 HSCN溶液分别与20mL 0.1mol•L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图1所示:
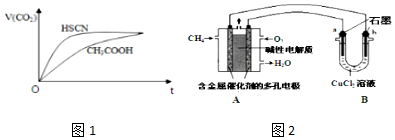
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快.
反应结束后所得两溶液中,c(CH3COO-)<c(SCN-)(填“>”、“<”或“=”)
③若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是b(填序号).
a.c(CH3COO-)b.c(H+)c.Kw d.醋酸电离平衡常数
(2)甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H1
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8kJ热量.
①该混合气体中NO和NO2的物质的量之比为3:1
②已知上述热化学方程式中△H1=-1160kJmol,则△H2=-574 kJ/mol.
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式4NO(g)=2NO2(g)+N2(g)△H=-293KJ/mol
(3)甲烷燃料电池可以提升能量利用率.图2是利用甲烷燃料电池电解50mL2mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是CH4-8e-+10OH-=CO32-+7H2O
②当A中消耗0.15mol氧气时,B中b极增重6.4g.