题目内容
17.(NH4)2SO4是常见的化肥和化工原料,受热易分解.某兴趣小组拟探究其分解产物.【查阅资料】(NH4)2SO4在260℃和400℃时分解产物不同.
【实验探究】该小组拟选用如图所示装置进行实验(夹持和加热装置略).

实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL).通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2.品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/LNaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00ml.经检验滴定后的溶液中无SO42-.
(1)仪器X的名称是圆底烧瓶.
(2)滴定前,下列操作的正确顺序是dbaec(填字母编号).
a.盛装0.2000mol/LNaOH溶液 b.用0.2000mol/LNaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是0.03mol.
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂.通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2.观察到装置A、D之间的导气管内有少量白色固体.经检验,该白色固体和装置D内溶液中有SO32-,无SO42-.进一步研究发现,气体产物中无氮氧化物.
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体.
(5)装置B内溶液吸收的气体是NH3.
(6)(NH4)2SO4在400℃分解的化学方程式是3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O↑.
分析 (1)仪器X为圆底烧瓶;
(2)滴定前,先检查滴定管是否漏水,再进行清洗,然后用标准液润洗,再注入标准液,排尽滴定尖嘴的气泡并调整液面,读数、记录,滴定前准备完成;
(3)根据消耗氢氧化钠计算B装置中剩余的HCl,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=
NH4Cl,进而计算吸收NH3的物质的量,
(4)取D溶液于试管中,加入足量BaCl2溶液,再加入盐酸,白色沉淀完全溶解且生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-;
(5)装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气;
(6)由(5)中分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,配平书写方程式.
解答 解:(1)由仪器X的结构可知,X为圆底烧瓶,故答案为:圆底烧瓶;
(2)滴定前,先检查滴定管是否漏水,再进行清洗,然后用标准液润洗,再注入标准液,排尽滴定尖嘴的气泡并调整液面,读数、记录,滴定前准备完成,故正确的顺序为:dbaec,
故答案为:dbaec;
(3)滴定剩余盐酸,终点时消耗NaOH为0.025L×0.2mol/L=0.005mol,故剩余HCl为0.005mol,则参加反应的HCl为0.07L×0.5mol/L-0.005mol=0.03mol,参加反应的HCl吸收分解生成的NH3,发生反应:NH3+HCl=NH4Cl,故吸收NH3的物质的量为0.03mol,
故答案为:0.03;
(4)检查装置D内溶液中有SO32-,无SO42-的实验操作和现象是:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体,说明D内溶液中有SO32-,无SO42-,
故答案为:取少许D溶液于试管中,加入足量BaCl2溶液,有白色沉淀生成,再加入盐酸,白色沉淀完全溶解,生成刺激性气味的气体;
(5)装置D内溶液中有SO32-,说明分解生成SO2,装置A、D之间的导气管内有少量白色固体,白色固体应是二氧化硫、氨气与水形成的盐,装置B内溶液吸收的气体是氨气,
故答案为:NH3;
(6)由(5)中分析可知,(NH4)2SO4在400℃分解时,有NH3、SO2、H2O生成,S元素化合价降低,根据电子转移守恒,只能为N元素化合价升高,气体产物中无氮氧化物,说明生成N2,分解反应方程式为:3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O↑;
故答案为:3(NH4)2SO4$\frac{\underline{\;400℃\;}}{\;}$4NH3↑+N2↑+3SO2↑+6H2O↑.
点评 本题考查化学实验,涉及化学仪器、滴定操作、实验方案设计、化学计算、物质推断、化学方程式书写等,是对学生综合能力的考查,较好的考查学生分析推理能力、知识迁移运用能力难度中等.

(1)计算:需要NaOH固体的质量为10.0g.
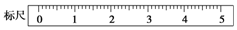
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,此时左边的托盘将(填“高于”或“低于”)右边的托盘.欲使天平平衡,所进行的操作为将左边的平衡螺母左旋移动,或将右边的平衡螺母左旋,直至天平平衡.假定最终称得小烧杯的质量为32.6(填“32.6g”或“31.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在标尺上画出游码的位置(画“△”表示).
| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 称量(取用砝码过程) |
(3)配制方法:设计五个操作步骤:
①向盛有NaOH的烧杯中加入200mL蒸馏水使其溶解,并冷却至室温.
②继续往容量瓶中加蒸馏水至液面接近刻度线1~2cm.
③将NaOH溶液沿玻璃棒注入500mL容量瓶中.
④在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶.
⑤改用胶头滴管加蒸馏水至刻度线,加盖摇匀.
试将以上操作排出先后顺序①③④②⑤.
(4)某学生实际配制NaOH溶液的浓度为0.48mol/L,原因可能是ACD.
A.使用滤纸称量氢氧化钠固体 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水后定容时仰视刻度.
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 酒精、硫酸钡和水分别属于电解质、强电解质和弱电解质 | |
| C. | 胶体区别于其它分散系的本质特性是具有丁达尔现象 | |
| D. | 利用半透膜可除去淀粉溶液中的少量NaCl |
| A. | Ca(NO3 )2(溶液) | B. | K2CO3(溶液) | C. | CH3COOK(固体) | D. | CuSO4 (固体) |
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
| A. | 若X、Y位于 IA族,则X、Y可能与氧元素形成原子个数比为1:1或2:1的化合物 | |
| B. | 若X、Y位于第3周期,则X、Y形成的化合物可能是离子化合物或共价化合物 | |
| C. | 若气态氢化物的沸点:X>Y,则X、Y只能位于周期表 VIIA族 | |
| D. | 若X、Y位于周期表的同一周期,则最高价含氧酸的酸性可能是HnXOm>HaYOb |
| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+) |
| A. | 常温常压下,溶解度小的无机盐不可能转化为溶解度相对大些的无机盐 | |
| B. | 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | |
| C. | 相同条件下,1L0.1mol/L的碳酸钠溶液的pH大于2L0.1mol/L的醋酸钠溶液的pH | |
| D. | 1L 1mol/L的碳酸钠溶液吸收S02的量大于1L 1mol/L硫化钠溶液吸收SO2的量 |
 图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.
图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.