题目内容
9.常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| C. | 将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(HA)>c(Na+)>c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:2c(R2-)+c(HR-)>c(Na+) |
分析 A.溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水电离被抑制,溶液中溶质可能是酸或碱;
B.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的NaA和HA,溶液pH大于7,说明NaA水解程度大于HA电离程度;
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则混合溶液中c(OH-)=c(H+),结合电荷守恒判断.
解答 解:A.溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,说明水电离被抑制,溶液中溶质可能是酸或碱,如果是酸,溶液的pH=14-a,如果是碱,溶液的pH=a,故A错误;
B.任何电解质溶液中都存在物料守恒,根据物料守恒得2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故B错误;
C.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后,溶液中溶质为等物质的量浓度的NaA和HA,溶液pH大于7,说明NaA水解程度大于HA电离程度,则溶液中存在c(HA)>c(Na+)>c(A-),故C正确;
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则混合溶液中c(OH-)=c(H+),结合电荷守恒得2c(R2-)+c(HR-)=c(Na+),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,侧重考查学生分析判断能力,明确混合溶液中溶质成分及其性质是解本题关键,注意结合溶液酸碱性判断离子浓度大小,会灵活运用电荷守恒和物料守恒,易错选项是B,注意:电荷守恒和物料守恒与溶液中溶质种类多少无关.

 阅读快车系列答案
阅读快车系列答案| 选项 | 实验事实 | 结论 |
| A | 其他条件相同,Na2S2O3溶液浓度越大,与同浓度的硫酸反应析出流沉淀所需的时间越短 | 当其他条件不变时,增大反应物浓度,化学反应速率增大 |
| B | 用铜作电极电解CuSO4溶液,CuSO4溶液浓度不变 | Cu2+没有参与电极反应 |
| C | 在常温下N2不能与O2反应,而白磷却能自燃 | 氮元素的非金属性比磷元素的弱 |
| D | 醋酸能与碱反应 | 醋酸分子一定不能存在于碱性溶液中 |
| A. | A | B. | B | C. | C | D. | D |
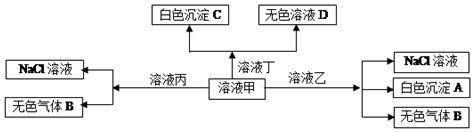
| A. | 在甲中滴加丁开始反应的离子方程式:HCO${\;}_{3}^{-}$+Ba2++OH-=BaCO3↓+H2O | |
| B. | 溶液丙中还可以大量共存的离子有:Fe2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 白色沉淀A可能溶解在溶液D中 | |
| D. | 甲为NaHCO3,乙为AlCl3 |
| A. | 氢氧化钠溶液 | B. | 澄清石灰水 | C. | 2 mol/L 盐酸 | D. | 2 mol/L 硫酸 |
| A. | pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位 | |
| B. | 1 L 0.50 mol/L NH4Cl 溶液与2 L 0.25 mol/L NH4Cl 溶液含NH4+ 物质的量后者大 | |
| C. | 误将钡盐(主要为BaCl2)当作食盐食用时,常用0.5%的Na2SO4溶液解毒;溶洞、珊瑚的形成;泡沫灭火器“泡沫”产生的原理均可用沉淀溶解平衡原理来解释 | |
| D. | pH=4、浓度均为0.1 mol•L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L |
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是a,b,d,c(填编号).
(2)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大,稀释后,HX溶液中水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
9.9×10-7mol/L(填准确数值).




