题目内容
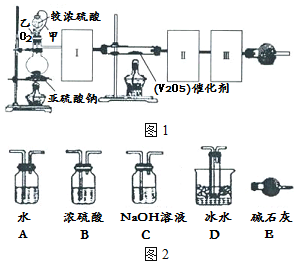
6. 图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.
图示装置可用来制取和观察Fe(OH)2在空气中被氧化时的颜色变化.实验时必须使用的药品是铁屑和6mol•L-1的硫酸,其它试剂任选.请填写下列空白:
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑;A中反应的 化学方程式是Fe+H2SO4=FeSO4+H2↑.
(2)实验开始时应先将活塞E打开(填“打开”“关闭”或“无关系”),目的是利用H2将装置中的空气排出;C中收集到气体的主要成分是H2.
(3)当C中收集到足量气体后,简述生成Fe(OH)2的操作及原因关闭活塞E,Fe与稀硫酸反应生成氢气,使烧瓶中气体压强增大,将A中溶液沿导管压入B中,产生白色沉淀Fe(OH)2,;
(4)欲观察Fe(OH)2在空气中被氧化时的颜色变化,需进行的下一步骤是拔去B装置的橡皮塞,使空气进入.
分析 制取和观察Fe(OH)2在空气中被氧化时的颜色变化,由实验装置可知,A中加固体铁屑,分液漏斗中为硫酸,A中发生Fe+H2SO4=FeSO4+H2↑,打开E,利用H2将装置中的空气排出,C中收集到不溶于水的气体主要为H2,然后关闭E,利用H2的压力将A中FeSO4溶液压入B中,B中FeSO4与NaOH反应生成白色沉淀Fe(OH)2,若观察颜色变化,可拔去B装置的橡皮塞,使空气进入,以此来解答.
解答 解:(1)B中盛有一定量的NaOH溶液,装药品时先固体后液体,A中应预先加入的试剂是铁屑;A中反应的化学方程式是Fe+H2SO4=FeSO4+H2↑,
故答案为:铁屑;Fe+H2SO4=FeSO4+H2↑;
(2)实验开始时应先将活塞E 打开,目的是利用H2将装置中的空气排出;C中收集到气体的主要成分是H2,
故答案为:打开;利用H2将装置中的空气排出;H2;
(3)当C中收集到足量气体后,生成Fe(OH)2的操作及原因为关闭活塞E,Fe与稀硫酸反应生成氢气,使烧瓶中气体压强增大,将A中溶液沿导管压入B中,产生白色沉淀Fe(OH)2,故答案为:关闭活塞E,Fe与稀硫酸反应生成氢气,使烧瓶中气体压强增大,将A中溶液沿导管压入B中,产生白色沉淀Fe(OH)2,;
(4)欲观察Fe(OH)2在空气中被氧化时的颜色变化,需进行的下一步骤是拔去B装置的橡皮塞,使空气进入,故答案为:拔去B装置的橡皮塞,使空气进入.
点评 本题考查氢氧化亚铁的制备实验,为高频考点,把握制备原理、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意氢气的作用,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
18.下列叙述正确的是(均在常温下)( )
| A. | pH=3的强酸溶液1 mL,加水稀释至100 mL后,溶液pH降低2个单位 | |
| B. | 1 L 0.50 mol/L NH4Cl 溶液与2 L 0.25 mol/L NH4Cl 溶液含NH4+ 物质的量后者大 | |
| C. | 误将钡盐(主要为BaCl2)当作食盐食用时,常用0.5%的Na2SO4溶液解毒;溶洞、珊瑚的形成;泡沫灭火器“泡沫”产生的原理均可用沉淀溶解平衡原理来解释 | |
| D. | pH=4、浓度均为0.1 mol•L-1 的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-4-10-10)mol/L |
18. 25℃时,电离平衡常数:
25℃时,电离平衡常数:
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是a,b,d,c(填编号).
(2)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大,稀释后,HX溶液中水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
9.9×10-7mol/L(填准确数值).
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是a,b,d,c(填编号).
(2)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000mL,稀释过程pH变化如图,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是稀释相同倍数,HX的pH变化比CH3COOH大,酸性强,电离平衡常数大,稀释后,HX溶液中水电离出来的c(H+)大于(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+),理由是HX酸性强于CH3COOH,稀释后c(H+)小于CH3COOH溶液中的c(H+),所以对水的抑制能力减弱;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO-)-c(Na+)=
9.9×10-7mol/L(填准确数值).
15.分子式为C5H10O2,且可以发生水解反应的同分异构体有( )种.
| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
16.向盛有10滴AgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成;继续向试管中滴加0.1mol/L KI溶液并振荡,沉淀变为黄色;再向试管中滴入0.1mol/L Na2S溶液并振荡,沉淀又变成黑色.根据上述变化过程,分析此三种沉淀物的溶解度关系为( )
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgCl>AgI>Ag2S | D. | AgI>AgCl>Ag2S |