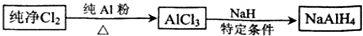题目内容
11.一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应:2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
分析 当气体的总物质的量减少0.8mol时反应达到平衡,则
2SO2(g)+O2(g)?2SO3(g)△n
2 1 2 1
1.6 0.8 1.6 0.8
平衡 0.4 0.2 1.6
A.再充入1molSO2和0.5molO2时,物质的量增大,压强增大,平衡正向移动;
B.相同温度下,起始时向容器中充入2mol SO3,K不变,
2SO2(g)+O2(g)?2SO3(g)
开始 0 0 2
转化 2x x 2x
平衡 2x x 2-2x
则$\frac{0.{8}^{2}}{0.1×0.{2}^{2}}$=$\frac{(1-x)^{2}}{\frac{x}{2}×{x}^{2}}$,解得x=0.2mol,转化的SO3为0.4mol;
C.由上述分析可知平衡时二氧化硫的物质的量为2mol-1.6mol;
D.若起始时向容器中充入2molSO3,转化的SO3为0.4mol,物质的量与热量成正比.
解答 解:当气体的总物质的量减少0.8mol时反应达到平衡,则
2SO2(g)+O2(g)?2SO3(g)△n
2 1 2 1
1.6 0.8 1.6 0.8
平衡 0.4 0.2 1.6
A.再充入1molSO2和0.5molO2时,物质的量增大,压强增大,平衡正向移动,则V(正)>V(逆),故A正确;
B.相同温度下,起始时向容器中充入2mol SO3,K不变,
2SO2(g)+O2(g)?2SO3(g)
开始 0 0 2
转化 2x x 2x
平衡 2x x 2-2x
则$\frac{0.{8}^{2}}{0.1×0.{2}^{2}}$=$\frac{(1-x)^{2}}{\frac{x}{2}×{x}^{2}}$,解得x=0.2mol,转化的SO3为0.4mol,达平衡时SO3的转化率为$\frac{0.4mol}{2mol}$×100%=20%,故B正确;
C.由上述分析可知平衡时二氧化硫的物质的量为2mol-1.6mol=0.4mol,故C错误;
D.正反应放热,可知逆反应吸热,若起始时向容器中充入2molSO3,转化的SO3为0.4mol,物质的量与热量成正比,则达平衡时吸收0.4mol×$\frac{196kJ}{2}$=39.2kJ的热量,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握转化的物质的量、K的计算及物质的量与热量的关系为解答的关键,侧重分析与计算能力的考查,注意选项B中K不变,题目难度不大.

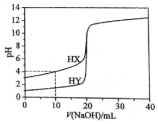 常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )
常温下,用浓度为0.1000mol•L-1的NaOH溶液分别逐滴加入到20.00mL 0.1000mol•L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图.下列说法正确( )| A. | V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(H+)>c(OH-) | |
| B. | V(NaOH)=20.00 mL时,两份溶液中,c(X-)>c(Y-) | |
| C. | V(NaOH)=20.00 mL时,c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | pH=7时,两份溶液中,c(X-)=c(Y-) |
①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3.
下列各微粒氧化能力由强到弱的顺序正确的是( )
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
| A. | 纯碱用于制造玻璃 | B. | 医药上用小苏打治疗胃酸过多 | ||
| C. | 打磨磁石制指南针 | D. | 工业上利用合成氨实现人工固氮 |
| A. | Ca(HCO3)2 | B. | Na2S | C. | FeI2 | D. | AlCl3 |
| A. | 同温同压下,反应H2(g)+Cl2(g)﹦2HCl(g) 在光照和点燃条件的△H相同 | |
| B. | 常温下,反应 C(s)+CO2(g)﹦2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | △H<0、△S>0的反应在任何条件下都能自发进行 | |
| D. | 反应N2(g)+3H2(g)?2NH3(g),加入催化剂能加快反应速率并提高转化率 |