题目内容
1.化学与科学、技术、社会和环境密切相关.下列有关说法中错误的是( )| A. | 同温同压下,反应H2(g)+Cl2(g)﹦2HCl(g) 在光照和点燃条件的△H相同 | |
| B. | 常温下,反应 C(s)+CO2(g)﹦2CO(g)不能自发进行,则该反应的△H>0 | |
| C. | △H<0、△S>0的反应在任何条件下都能自发进行 | |
| D. | 反应N2(g)+3H2(g)?2NH3(g),加入催化剂能加快反应速率并提高转化率 |
分析 A.焓变与反应条件无关;
B.△H-T△S<0,可自发进行;
C.△H<0、△S>0,则△H-T△S<0;
D.催化剂可加快反应速率,对平衡移动无影响.
解答 解:A.焓变与反应条件无关,则同温同压下,反应H2(g)+Cl2(g)﹦2HCl(g) 在光照和点燃条件的△H相同,故A正确;
B.反应 C(s)+CO2(g)﹦2CO(g)不能自发进行,△S>0,△H-T△S>0,则该反应的△H>0,故B正确;
C.△H<0、△S>0,则△H-T△S<0,则△H<0、△S>0的反应在任何条件下都能自发进行,故C正确;
D.催化剂可加快反应速率,对平衡移动无影响,则反应N2(g)+3H2(g)?2NH3(g),加入催化剂能加快反应速率,但转化率不变,故D错误;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、化学反应进行的方向判断、平衡移动为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应:
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
12.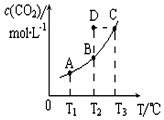 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
9.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
16.下列叙述正确的是( )
| A. | 分散质粒子的直径在1~100 nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体属于电解质溶液 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | Fe(OH)3胶体带正电荷,可以产生电泳现象 |
6.甲醇汽油是由10%~25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标.工业上合成甲醇一般采用下列反应:CO(g)+2H2(g)?CH3OH(g)△H=a kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
(1)由表中数据判断,反应中a<0(填“>”、“=”或“<”).
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol•L-1,则此时的温度为310℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
①反应从2 min到4min之间,H2的反应速率为0.3mol/(L•min).
②反应达到平衡时CO的转化率为62.5%.
③反应在第2min时改变了反应条件,改变的条件可能是A(填序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2mol H2,发生反应CO(g)+2 H2(g)?CH3OH(g)△H=a kJ/mol.恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;
已知T1<T2,则ω1Dω2(填序号).
A.大于 B.小于 C.等于 D.以上都有可能.
下表是该反应在不同温度下的化学平衡常数(K):
| 温度/℃ | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.5mol•L-1,则此时的温度为310℃.
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min/浓度mol/L | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
②反应达到平衡时CO的转化率为62.5%.
③反应在第2min时改变了反应条件,改变的条件可能是A(填序号).
A.使用催化剂 B.降低温度 C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2mol H2,发生反应CO(g)+2 H2(g)?CH3OH(g)△H=a kJ/mol.恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;
已知T1<T2,则ω1Dω2(填序号).
A.大于 B.小于 C.等于 D.以上都有可能.
3.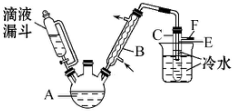 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是abc( 多选 ).
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO2+Br2+2H2O.
(3)加热的目的是加快反应速率,蒸馏出溴乙烷.
(4)图中试管C中的导管E的末端必须在水面以下,其原因是通过冷却得到溴乙烷,减少溴乙烷的挥发.
(5)为除去产品中的一种主要杂质,最好选择下列D(选填序号)溶液来洗涤产品.
A.氢氧化钠 B.氯化钠
C.碘化亚铁 D.亚硫酸钠
(6)第(5)题的实验所需要的玻璃仪器有分液漏斗、烧杯.
 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是abc( 多选 ).
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO2+Br2+2H2O.
(3)加热的目的是加快反应速率,蒸馏出溴乙烷.
(4)图中试管C中的导管E的末端必须在水面以下,其原因是通过冷却得到溴乙烷,减少溴乙烷的挥发.
(5)为除去产品中的一种主要杂质,最好选择下列D(选填序号)溶液来洗涤产品.
A.氢氧化钠 B.氯化钠
C.碘化亚铁 D.亚硫酸钠
(6)第(5)题的实验所需要的玻璃仪器有分液漏斗、烧杯.
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.