题目内容
16.下列应用涉及氧化还原反应的是( )| A. | 纯碱用于制造玻璃 | B. | 医药上用小苏打治疗胃酸过多 | ||
| C. | 打磨磁石制指南针 | D. | 工业上利用合成氨实现人工固氮 |
分析 氧化还原反应的特征是元素化合价的升降,如发生氧化还原反应,应存在元素化合价的变化,结合对应物质的性质解答该题.
解答 解:A.纯碱用于制造玻璃,没有元素的化合价变化,不发生氧化还原反应,故A错误;
B.医药上用小苏打治疗胃酸过多,没有元素的化合价变化,不发生氧化还原反应,故B错误;
C.打磨磁石制指南针,属于物理变化,故C错误;
D.人工固氮,氮气生成氨气、氮氧化物等物质,N元素化合价发生变化,属于氧化还原反应,故D正确.
故选D.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
11.一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应:
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
1.下列有关元素及其化合物的说法正确的是( )
| A. | 水蒸气通过灼热的铁粉生成氢氧化铁和氢气 | |
| B. | Mg比Al活泼,更易与NaOH溶液反应生成H2 | |
| C. | Na在空气中长期放置最终变为Na2CO3粉末 | |
| D. | 向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
5.若mg氢气中含n个氢原子,则阿伏加德罗常数可表示为( )
| A. | 2nmol-1 | B. | $\frac{n}{m}$mol-1 | C. | $\frac{2n}{m}$mol-1 | D. | nmol-1 |
 实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.
实验室制备乙酸乙酯,是将3mL乙醇加入一支试管中,然后边振荡试管,边慢慢加入2mL浓H2SO4和2mL乙酸,按如图连接好装置,在酒精灯上加热.观察现象.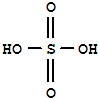 )溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯(
)溶于乙醇中并不是简单的物理溶解而是伴随着化学反应,生成了硫酸乙酯( )和硫酸二乙酯(
)和硫酸二乙酯(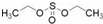 ).
).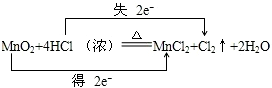 ;
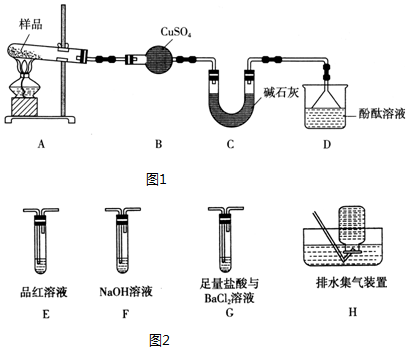
;
 T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.
T℃时,在一个体积为2L的容器中,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图所示.