题目内容
20.(1)写出下列反应的离子方程式:①氯化铵溶液和氢氧化钠溶液反应NH4++OH-=NH3•H2O
②少量二氧化碳通入澄清石灰水CO2+Ca2++2OH-=CaCO3↓+H2O
③三氧化二铁和盐酸反应Fe2O3+6H+=2Fe3++3H2O
(2)写出符合下列离子反应的化学方程式:
①CO32-+Ba2+=BaCO3↓Na2CO3+BaCl2=BaCO3↓+2NaCl
②Cu2++Fe=Cu+Fe2+Fe+CuCl2=Cu+FeCl2.
分析 (1)①铵根离子与氢氧根离子反应是NH3•H2O;
②二氧化碳与氢氧化钙反应生成碳酸钙沉淀;
③三氧化二铁和盐酸反应生成氯化铁和水;
(2)①可溶性碳酸盐与可溶性钡盐反应生成碳酸钡和可溶性盐的离子反应为CO32-+Ba2+=BaCO3↓;
②Fe与可溶性铜盐反应生成Cu和可溶性亚铁盐的离子反应为Cu2++Fe=Cu+Fe2+.
解答 解:(1)①铵根离子与氢氧根离子反应是NH3•H2O,其反应的离子方程式为:NH4++OH-=NH3•H2O;
故答案为:NH4++OH-=NH3•H2O;
②二氧化碳与氢氧化钙反应生成碳酸钙沉淀,其反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
③三氧化二铁和盐酸反应生成氯化铁和水,其反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)①可溶性碳酸盐与可溶性钡盐反应生成碳酸钡和可溶性盐的离子反应为CO32-+Ba2+=BaCO3↓,如:Na2CO3+BaCl2=BaCO3↓+2NaCl,
故答案为:Na2CO3+BaCl2=BaCO3↓+2NaCl;
②Fe与可溶性铜盐反应生成Cu和可溶性亚铁盐的离子反应为Cu2++Fe=Cu+Fe2+,如:Fe+CuCl2=Cu+FeCl2,
故答案为:Fe+CuCl2=Cu+FeCl2.
点评 本题考查离子反应方程式的书写,为高考常见题型,侧重量有关的离子反应的考查,明确发生的化学反应及离子反应的书写方法即可解答,题目难度中等.

练习册系列答案
相关题目
11.一定条件下在2L的密闭容器中,充入2mol SO2和1molO2发生反应:
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
2SO2(g)+O2(g)?2SO3(g)△H=-196kJ•moL-1,当气体的总物质的量减少0.8mol时反应达到平衡,下列有关叙述不正确的是( )
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
15.我国发生的“三聚氰胺奶制品事件”已经造成多名患儿死亡.三聚氰胺是由碳、氢、氧、氮等元素组成,不法分子在奶制品中添加三聚氰胺的目的是为了提高牛奶中下列哪种成分的含量( )
| A. | 油脂 | B. | 矿物质 | C. | 蛋白质 | D. | 维生素 |
5.若mg氢气中含n个氢原子,则阿伏加德罗常数可表示为( )
| A. | 2nmol-1 | B. | $\frac{n}{m}$mol-1 | C. | $\frac{2n}{m}$mol-1 | D. | nmol-1 |
12.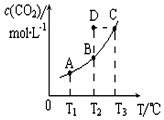 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
9.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
3.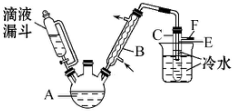 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
乙醇、溴乙烷、溴有关参数
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是abc( 多选 ).
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO2+Br2+2H2O.
(3)加热的目的是加快反应速率,蒸馏出溴乙烷.
(4)图中试管C中的导管E的末端必须在水面以下,其原因是通过冷却得到溴乙烷,减少溴乙烷的挥发.
(5)为除去产品中的一种主要杂质,最好选择下列D(选填序号)溶液来洗涤产品.
A.氢氧化钠 B.氯化钠
C.碘化亚铁 D.亚硫酸钠
(6)第(5)题的实验所需要的玻璃仪器有分液漏斗、烧杯.
 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是abc( 多选 ).
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发d.水是反应的催化剂
(2)写出溴化氢与浓硫酸加热时发生反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$SO2+Br2+2H2O.
(3)加热的目的是加快反应速率,蒸馏出溴乙烷.
(4)图中试管C中的导管E的末端必须在水面以下,其原因是通过冷却得到溴乙烷,减少溴乙烷的挥发.
(5)为除去产品中的一种主要杂质,最好选择下列D(选填序号)溶液来洗涤产品.
A.氢氧化钠 B.氯化钠
C.碘化亚铁 D.亚硫酸钠
(6)第(5)题的实验所需要的玻璃仪器有分液漏斗、烧杯.