题目内容
NA代表阿伏加德罗常数,以下说法正确的是( )
| A、氯化氢气体的摩尔质量等于NA个氯气分子和NA个氢分子的质量之和 |
| B、常温常压下1mol NO2气体与水反应生成NA个NO3-离子 |
| C、121g CCl2F2所含的氯原子数为2NA |
| D、62g Na2O溶于水后所得溶液中含有O2-离子数为NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、摩尔质量与质量是两个不同的物理量;
B、依据反应3NO2+H2O═2HNO3+NO分析解读答;
C、121gCCl2F2的物质的量为:
=1mol,1mol该物质中含有2mol氯原子;
D、Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子;
B、依据反应3NO2+H2O═2HNO3+NO分析解读答;
C、121gCCl2F2的物质的量为:
| 121g |
| 121g/mol |
D、Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子;
解答:
解:A、摩尔质量单质为g/mol,质量单位为g,二者是不同的物理量,故A错误;
B、依据3NO2+H2O═2HNO3+NO,可知1 mol NO2气体与水反应生成硝酸的物质的量为
mol,所以生成硝酸根离子的物质的量为
NA,故B错误;
C、121gCCl2F2的物质的量为1mol,含有2mol氯原子,含有的氯原子数为2NA,故C正确;
D、Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子,故D错误.
故选C.
B、依据3NO2+H2O═2HNO3+NO,可知1 mol NO2气体与水反应生成硝酸的物质的量为
| 2 |
| 3 |
| 2 |
| 3 |
C、121gCCl2F2的物质的量为1mol,含有2mol氯原子,含有的氯原子数为2NA,故C正确;
D、Na2O溶于水后和水反应生成NaOH,故所得溶液中无O2-离子,故D错误.
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、水泥、玻璃、陶瓷都是硅酸盐产品,均属于无机非金属材料 |
| B、明矾、漂白粉、臭氧都可作净水剂,其净水原理相同 |
| C、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
| D、绿色化学的核心是应用化学原理对环境污染进行治理 |
能正确表示下列反应的离子方程式为( )
| A、向明矾溶液中加入足量的氢氧化钡溶液Ba2++4OH-+Al3++SO42-=BaSO4↓+AlO2-+2H2O |
| B、酸性高锰酸钾溶液与草酸溶液混合2MnO4-+5C2O42-+16H+=2Mn2++10 CO2↑+8H2O |
| C、将等物质的量浓度的氯水与FeI2溶液混合2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl- |
| D、向氢氧化钡溶液中通入足量的SO2气体OH-+SO2=HSO3- |
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、22.4 L甲烷(CH4)所含的原子数为5NA |
| C、0.5 molCuO的摩尔质量为40g/mol |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3NA |
X、Y、Z、M、W原子序数依次增大的5种短周期元素.X的质子总数与电子层数相同,Y、Z、M同周期且相邻,W原子核外电子数是M原子最外层电子数的2倍,Z与其同主族的短周期无素可形成一种常见气体,X、Y、Z3种元素形成化合物甲,下列说法不正确的是( )
| A、原子半径:W>Y>Z>M>X |
| B、化合物甲中可能含有离子键和共价键 |
| C、由W元素形成的单质在自然界的贮量丰富,并存在大量的单质 |
| D、X分别与Y、Z、M、W形成的常见化合物中,稳定性最好的是XM |
下列实验现象对应的反应方程式正确的是( )
| A、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| B、切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2=2Na2O |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
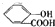 )中液加NaHCO3溶液
)中液加NaHCO3溶液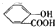 +2HCO3-═
+2HCO3-═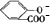 +2CO2↑+2H2O,
+2CO2↑+2H2O,