题目内容
苯亚甲基苯乙酮俗称查尔酮,淡黄色梭状晶体,相对分子质量为208,熔点为58℃,沸点为208℃(3.3kPa),易溶于醚、氯仿和苯,微溶于醇.
已知:苯甲醛的密度为1.04g/mL,相对分子质量为106;苯乙酮的密度为1.0281g/mL,相对分子质量为120.查尔酮的制备原理如图1:
(1)装苯甲醛的仪器名称(图2)是 .
(2)制备过程中,需在搅拌下滴加苯甲醛,发现温度还是上升很快,可采取 .
(3)产品结晶前,可以加入几粒成品的查尔酮,其作用是 .
(4)结晶完全后,抽滤收集产物.若发现产品的颜色较深,这时应进行进一步操作为 .
(5)已知装入三颈烧瓶的苯乙酮的体积为17.5mL,滴人烧瓶中苯甲醛的体积为10.2mL,最后得到产品的质量为10.4g,则产率为 .
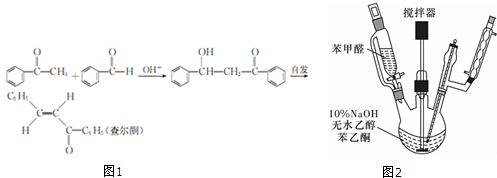
已知:苯甲醛的密度为1.04g/mL,相对分子质量为106;苯乙酮的密度为1.0281g/mL,相对分子质量为120.查尔酮的制备原理如图1:
(1)装苯甲醛的仪器名称(图2)是
(2)制备过程中,需在搅拌下滴加苯甲醛,发现温度还是上升很快,可采取
(3)产品结晶前,可以加入几粒成品的查尔酮,其作用是
(4)结晶完全后,抽滤收集产物.若发现产品的颜色较深,这时应进行进一步操作为
(5)已知装入三颈烧瓶的苯乙酮的体积为17.5mL,滴人烧瓶中苯甲醛的体积为10.2mL,最后得到产品的质量为10.4g,则产率为

考点:性质实验方案的设计,制备实验方案的设计
专题:实验设计题
分析:(1)根据装苯甲醛的仪器的构造写出其名称;
(2)可采用冰水浴冷却的方法降低反应温度;
(3)滴加苯甲醛后可以提供晶种,加速结晶;
(4)发现产品的颜色较深,可以通过重结晶的方法除去杂质;
(5)根据n=
计算出苯乙酮、苯甲醛的物质的量,然后根据图1中反应原理判断过量,计算出理论上生成查尔酮的质量,再计算出产率.
(2)可采用冰水浴冷却的方法降低反应温度;
(3)滴加苯甲醛后可以提供晶种,加速结晶;
(4)发现产品的颜色较深,可以通过重结晶的方法除去杂质;
(5)根据n=
| m |
| M |
解答:
解:(1)根据图示可知,装苯甲醛的仪器名称为恒压分液漏斗,
故答案为:恒压分液漏斗;
(2)制备过程中,需在搅拌下滴加苯甲醛,发现温度还是上升很快,如温度过高时,则可采用冰水浴冷却措施,
故答案为:冰水浴冷却;
(3)有时溶液是过饱和溶液但是无晶核,因此不能析出晶体,在产品结晶前,可以加入几粒成品的查尔酮,其作用是提供晶种,加速结晶,
故答案为:提供晶种,加速结晶;
(4)发现产品的颜色较深,说明含有杂质,这时应通过重结晶的操作方法除去杂质,
故答案为:重结晶;
(5)苯甲醛的密度为1.04g/mL,相对分子质量为106,10.2mL苯甲醛的物质的量为:
≈0.10mol,
苯乙酮的密度为1.0281g/mL,相对分子质量为120,17.5mL苯乙酮的物质的量为:
≈0.15mol,
根据图1可知,苯甲醛与苯乙酮按照物质的量1:1反应生成查尔酮,则苯乙酮过量,二者完全反应理论上生成0.10mol产品,
则产率为:
×100%=50%,
故答案为:50%.
故答案为:恒压分液漏斗;
(2)制备过程中,需在搅拌下滴加苯甲醛,发现温度还是上升很快,如温度过高时,则可采用冰水浴冷却措施,
故答案为:冰水浴冷却;
(3)有时溶液是过饱和溶液但是无晶核,因此不能析出晶体,在产品结晶前,可以加入几粒成品的查尔酮,其作用是提供晶种,加速结晶,
故答案为:提供晶种,加速结晶;
(4)发现产品的颜色较深,说明含有杂质,这时应通过重结晶的操作方法除去杂质,
故答案为:重结晶;
(5)苯甲醛的密度为1.04g/mL,相对分子质量为106,10.2mL苯甲醛的物质的量为:
| 1.04g/mL×10.2mL |
| 106g/mol |
苯乙酮的密度为1.0281g/mL,相对分子质量为120,17.5mL苯乙酮的物质的量为:
| 1.0281g/mL×17.5mL |
| 120g/mol |
根据图1可知,苯甲醛与苯乙酮按照物质的量1:1反应生成查尔酮,则苯乙酮过量,二者完全反应理论上生成0.10mol产品,
则产率为:
| 10.4g |
| 208g/mol×0.10mol |
故答案为:50%.
点评:本题考查了物质制取过程中反应条件的选择、混合物的分离方法、物质转化率的检验方法的知识,题目难度中等,注意掌握化学实验基本操作方法及其综合应用,试题有利于培养学生的分析、理解能力及化学实验能力.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
钬的一种同位素
Ho可用于制作医疗激光器,其原子核内中子数与核外电子数之差是( )
165 67 |
| A、31 | B、67 | C、98 | D、165 |
关于物质的分类正确的是( )
| A、SO2、CO2、CO、NO2都是酸性氧化物 |
| B、Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 |
| C、HCl、HClO、HNO3、HClO4都是强酸 |
| D、NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 |
容积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下反应N2+3H2?2NH3,达平衡时容积为V L,混合气体中氨气占总体积的20%,若压强温度不变,下列推论不正确的是( )
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
下列实验操作中错误的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时应将溶液蒸干 |
| D、称量NaOH,称量物放在小烧杯中置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
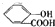 )中液加NaHCO3溶液
)中液加NaHCO3溶液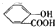 +2HCO3-═
+2HCO3-═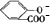 +2CO2↑+2H2O,
+2CO2↑+2H2O,