题目内容
 氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
氮化硅是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2
| ||
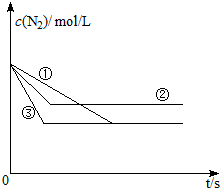
(1)在容积固定的密闭容器中,分别在三种不同的实验条件下进行上述制备反应,测得N2的物质的量浓度随时间的变化如图所示,②和③分别仅改变一种反应条件.所改变的条件分别是:②
(2)1 000℃时,在2L密闭容器中进行上述反应,若起始时N2浓度为4.0mol/L,经1小时反应达到平衡状态,此时容器内气体总浓度为10.0mol/L,则以CO表示的反应速率为
考点:物质的量或浓度随时间的变化曲线,化学平衡的计算
专题:
分析:(1)根据图象,曲线②与①相比,反应速率变快,且达新平衡时氮气的浓度变大即增加氮气的浓度或平衡逆向移动,曲线③与①相比,反应速率变快,但在新平衡时氮气的浓度不变,即平衡没有移动,据此答题;
(2)根据化学方程式计算平衡时CO的浓度,再根据v=
计算反应速率,根据Q(c)与K的大小关系判断反应移动的方向,据此答题;
(2)根据化学方程式计算平衡时CO的浓度,再根据v=
| △c |
| t |
解答:
解:(1)根据图象,曲线②与①相比,反应速率变快,且达新平衡时氮气的浓度变大即增加氮气的浓度或平衡逆向移动,而根据图可知,曲线①和②氮气的起始浓度相同,也就是氮的浓度没有改变,且由于该反应的正反应为放热反应,所以此时改变的条件为升高温度或通入CO,曲线③与①相比,反应速率变快,但在新平衡时氮气的浓度不变,即平衡没有移动,所以此时改变的条件为加入催化剂,
故答案为:升温或通CO;加入催化剂;
(2)根据3SiO2+6C+2N2
Si3N4+6CO,设平衡时,CO的浓度为xmol/L,根据题意有4.0-
x+x=10,所以x=9,根据v=
=
=0.15 mol?L-1?min-1,此时N2浓度为1.0mol/L,所以K=
=96,当某时刻测得N2和CO的浓度均为6.0mol/L,此时Q(c)=
=64<96,所以此时反应未达平衡,要向正反应方向移动,所以V正>V逆,
故答案为:0.15 mol?L-1?min-1; 大于.
故答案为:升温或通CO;加入催化剂;
(2)根据3SiO2+6C+2N2
| ||
| 1 |
| 3 |
| △c |
| t |
| 9mol/L |
| 60min |
| 96 |
| 12 |
| 66 |
| 62 |
故答案为:0.15 mol?L-1?min-1; 大于.
点评:本题主要考查了化学反应速率的计算、影响平衡移动的因素、平衡常数的计算和应用,中等难度,解题的难度是第(2)问中的平衡常数的计算和应用.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
下列实验现象对应的反应方程式正确的是( )
| A、向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl- |
| B、切开的金属Na暴露在空气中,光亮表面逐渐变暗4Na+O2=2Na2O |
| C、Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2 |
| D、向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
钬的一种同位素
Ho可用于制作医疗激光器,其原子核内中子数与核外电子数之差是( )
165 67 |
| A、31 | B、67 | C、98 | D、165 |
关于物质的分类正确的是( )
| A、SO2、CO2、CO、NO2都是酸性氧化物 |
| B、Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 |
| C、HCl、HClO、HNO3、HClO4都是强酸 |
| D、NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 |
容积可变的密闭容器中盛有适量的N2和H2的混合气体,在一定条件下反应N2+3H2?2NH3,达平衡时容积为V L,混合气体中氨气占总体积的20%,若压强温度不变,下列推论不正确的是( )
| A、原N2、H2混合气体为1.0V L |
| B、原N2、H2混合气体为1.2V L |
| C、参加反应的N2为0.1V L |
| D、原混合气体中N2、H2体积比为1:3 |
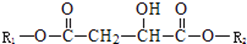 (其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
(其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化: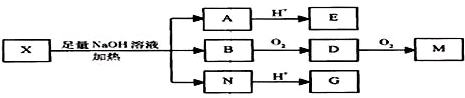
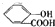 )中液加NaHCO3溶液
)中液加NaHCO3溶液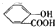 +2HCO3-═
+2HCO3-═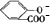 +2CO2↑+2H2O,
+2CO2↑+2H2O,
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题:
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此回答下列问题: