题目内容
A、B、C、D、E、F是原子序数依次增大的短周期元素.A元素最低负化合价的绝对值与其原子最外层电子数相等;C的单质与下一周期同族元素的单质形成的液态合金是原子反应堆的导热剂.
( l ) C与B形成的一种化合物是常用生氧剂,该化合物中存在的化学键类型为 ;
( 2 ) F的单质常用于自来水杀菌消毒,其与水反应所生成的弱电解质的电子式为 ;AF4是一种常见的有机溶剂,其分子的空间构型为 ;
( 3 ) D的单质和氧化物均为原子晶体,则1mol D的氧化物晶体中含有 mol 的共价键;
(4)B、C、D三种元素的原子半径由小到大的顺序为 (填元素符号);
(5)EB2是一种能使品红褪色的气体,它通入足量的BaCl2和HNO3的混合溶液时生成白色沉淀和一种无色气体,有关反应的离子方程式为 ,当标准状况下生成3.36L无色气体时,转移的电子数目为 .
( l ) C与B形成的一种化合物是常用生氧剂,该化合物中存在的化学键类型为
( 2 ) F的单质常用于自来水杀菌消毒,其与水反应所生成的弱电解质的电子式为
( 3 ) D的单质和氧化物均为原子晶体,则1mol D的氧化物晶体中含有
(4)B、C、D三种元素的原子半径由小到大的顺序为
(5)EB2是一种能使品红褪色的气体,它通入足量的BaCl2和HNO3的混合溶液时生成白色沉淀和一种无色气体,有关反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E、F是原子序数依次增大的短周期元素.C的单质与下一周期同族元素的单质形成的液态合金是原子反应堆的导热剂,则C为钠元素,C与B形成的一种化合物是常用生氧剂,则B为氧元素,F的单质常用于自来水杀菌消毒,则F为氯元素,AF4是一种常见的有机溶剂,且A元素最低负化合价的绝对值与其原子最外层电子数相等,则A为碳元素,D的单质和氧化物均为原子晶体,则D为硅元素,EB2是一种能使品红褪色的气体,则E为硫元素,据此答题;
解答:
解:A、B、C、D、E、F是原子序数依次增大的短周期元素.C的单质与下一周期同族元素的单质形成的液态合金是原子反应堆的导热剂,则C为钠元素,C与B形成的一种化合物是常用生氧剂,则B为氧元素,F的单质常用于自来水杀菌消毒,则F为氯元素,AF4是一种常见的有机溶剂,且A元素最低负化合价的绝对值与其原子最外层电子数相等,则A为碳元素,D的单质和氧化物均为原子晶体,则D为硅元素,EB2是一种能使品红褪色的气体,则E为硫元素,
( l ) C与B形成的一种化合物是常用生氧剂为过氧化钠,该化合物中存在的化学键类型为离子键、非极性共价键,
故答案为:离子键、非极性共价键;
( 2 ) F的单质常用于自来水杀菌消毒,其与水反应所生成的弱电解质为次氯酸,它的电子式为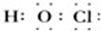 ;AF4是一种常见的有机溶剂为四氯化碳,其分子的空间构型为 正四面体,
;AF4是一种常见的有机溶剂为四氯化碳,其分子的空间构型为 正四面体,
故答案为: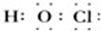 ; 正四面体;
; 正四面体;
( 3 ) D的单质和氧化物均为原子晶体,在二氧化硅晶体中,每个硅原子周围有4个硅氧键,则1mol 二氧化硅晶体中含有4 mol 的共价键,
故答案为:4;
(4)电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以B、C、D三种元素的原子半径由小到大的顺序为O<Si<Na,
故答案为:O<Si<Na;
(5)EB2是一种能使品红褪色的气体,它通入足量的BaCl2和HNO3的混合溶液时生成白色沉淀和一种无色气体一氧化氮,有关反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+4H++2NO,在反应中每生成2molNO时有6mol电子发生转移,所以当标准状况下生成3.36L无色气体即0.15mol时,转移的电子数目为0.45NA,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+4H++2NO;0.45NA.
( l ) C与B形成的一种化合物是常用生氧剂为过氧化钠,该化合物中存在的化学键类型为离子键、非极性共价键,
故答案为:离子键、非极性共价键;
( 2 ) F的单质常用于自来水杀菌消毒,其与水反应所生成的弱电解质为次氯酸,它的电子式为
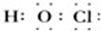 ;AF4是一种常见的有机溶剂为四氯化碳,其分子的空间构型为 正四面体,
;AF4是一种常见的有机溶剂为四氯化碳,其分子的空间构型为 正四面体,故答案为:
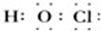 ; 正四面体;
; 正四面体;( 3 ) D的单质和氧化物均为原子晶体,在二氧化硅晶体中,每个硅原子周围有4个硅氧键,则1mol 二氧化硅晶体中含有4 mol 的共价键,
故答案为:4;
(4)电子层数越多,半径越大,电子层数相同时,核电荷数越多,半径越小,所以B、C、D三种元素的原子半径由小到大的顺序为O<Si<Na,
故答案为:O<Si<Na;
(5)EB2是一种能使品红褪色的气体,它通入足量的BaCl2和HNO3的混合溶液时生成白色沉淀和一种无色气体一氧化氮,有关反应的离子方程式为3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+4H++2NO,在反应中每生成2molNO时有6mol电子发生转移,所以当标准状况下生成3.36L无色气体即0.15mol时,转移的电子数目为0.45NA,
故答案为:3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+4H++2NO;0.45NA.
点评:本题主要考查了化学键、电子式、分子空间构型、半径比较、氧化还原反应等知识,中等难度,元素推断是解题的关键,答题时注意化学用语的正确表达.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A、常温常压下,28 g氮气所含的原子数为2NA |
| B、22.4 L甲烷(CH4)所含的原子数为5NA |
| C、0.5 molCuO的摩尔质量为40g/mol |
| D、2L 1mol?L-1K2SO4溶液中离子的总数为3NA |
关于物质的分类正确的是( )
| A、SO2、CO2、CO、NO2都是酸性氧化物 |
| B、Na2O、Na2O2、Fe2O3、CuO都是碱性氧化物 |
| C、HCl、HClO、HNO3、HClO4都是强酸 |
| D、NaOH、KOH、Ba(OH)2、Ca(OH)2都是强碱 |
下列实验操作正确的是( )
| A、用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、蒸馏石油时,应使温度计水银球放在蒸馏烧瓶的支管口处 |
| C、分液操作时,上层液体经分液漏斗下口放出 |
| D、为了便于操作,浓溶液稀释或固体溶解可直接在容量瓶中进行 |
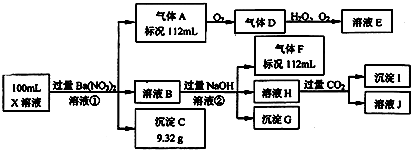
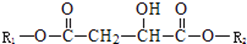 (其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
(其中R1、R2为未知部分的结构),已知X可以发生如图所示的转化:
 )中液加NaHCO3溶液
)中液加NaHCO3溶液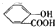 +2HCO3-═
+2HCO3-═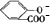 +2CO2↑+2H2O,
+2CO2↑+2H2O,