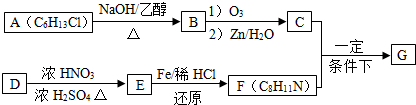
题目内容
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOX、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H= .
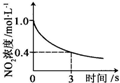
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率v(N2)= .
②在该温度下,反应的平衡常数K= (写出表达式)= .(写出计算结果)
③对于该可逆反应,通过综合分析以上信息,至少可以说明 (填字母).
A.该反应的反应物混合后很不稳定
B.该反应体系达到平衡时至少有一种反应物的百分含量减小
C.该反应在一定条件下能自发进行
D.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇一氧化钠,其中O2-可以在固体介质NASICON中自由移动.
①负极的电极反应式为:
②工作时O2-由电极 流向电极 (填a或b)

(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
尾气转化的反应之一:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:

| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×10-4mol?L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=
②在该温度下,反应的平衡常数K=
③对于该可逆反应,通过综合分析以上信息,至少可以说明
A.该反应的反应物混合后很不稳定
B.该反应体系达到平衡时至少有一种反应物的百分含量减小
C.该反应在一定条件下能自发进行
D.该反应使用催化剂意义不大
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇一氧化钠,其中O2-可以在固体介质NASICON中自由移动.
①负极的电极反应式为:
②工作时O2-由电极

考点:用盖斯定律进行有关反应热的计算,常见化学电源的种类及其工作原理,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律计算所需热化学方程式;
(2)①根据化学反应速率v=
求出NO的化学反应速率,然后根据速率之比等于化学计量数之比;
②根据三段式计算各物质的平衡浓度,然后根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积来求出;
③根据化学反应的速率和方向知识进行回答;
(3)依据原电池反应原理分析判断电极名称和电极反应,依据电极反应分析.
(2)①根据化学反应速率v=
| △c |
| △t |
②根据三段式计算各物质的平衡浓度,然后根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积来求出;
③根据化学反应的速率和方向知识进行回答;
(3)依据原电池反应原理分析判断电极名称和电极反应,依据电极反应分析.
解答:
解:(1)①N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③×2-①-②得到热化学方程式:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5 kJ?mol-1
故答案为:-746.5 kJ?mol-1;
(2)①前2s内的平均反应速率v (NO)=
=3.75×10-4mo?L-1?s-1,v(N2)=
v(NO)=1.88×10-4mo?L-1?s-1,
故答案为:1.88×10-4mo?L-1?s-1;
②依据化学平衡三段式计算
2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 9×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 9×10-4 9×10-4
平衡常数K=
=
=5000L/mol,
故答案为:
;5000L/mol;
③A.该反应的反应物混合后很稳定,在一定条件下,如加入催化剂才能发生反应,故A错误;
B.该反应一旦发生,将在很短的时间内完成,故B正确;
C.该反应进行的程度大,反应体系达到平衡时至少有一种反应物的百分含量较小,故C正确;
D.该反应使用催化剂能加快反应速率,故E错误;
故选:BC;
(3)①负极的电极反应式为:CO+O2--2e-═CO2,故答案为:CO+O2--2e-=CO2;
②该燃料电池的正极反应为:O2+4e-=2O2-,生成的O2-由b极向a极迁移,故答案为:b;a.
②2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1
③C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
③×2-①-②得到热化学方程式:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H=-746.5 kJ?mol-1
故答案为:-746.5 kJ?mol-1;
(2)①前2s内的平均反应速率v (NO)=
| (10-2.5)×10-4mol/L |
| 2s |
| 1 |
| 2 |
故答案为:1.88×10-4mo?L-1?s-1;
②依据化学平衡三段式计算
2NO(g)+2CO(g)=N2(g)+2CO2(g)
初始浓度:10×10-4 3.6×10-3 0 0
变化浓度:9×10-4 9×10-4 9×10-4 9×10-4
平衡浓度:1×10-4 2.7×10-3 9×10-4 9×10-4
平衡常数K=
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
| (9×10-4)?(9×10-4)2 |
| (1×10-4)?(2.7×10-3)2 |
故答案为:
| c(N2)c2(CO2) |
| c2(NO)c2(CO) |
③A.该反应的反应物混合后很稳定,在一定条件下,如加入催化剂才能发生反应,故A错误;
B.该反应一旦发生,将在很短的时间内完成,故B正确;
C.该反应进行的程度大,反应体系达到平衡时至少有一种反应物的百分含量较小,故C正确;
D.该反应使用催化剂能加快反应速率,故E错误;
故选:BC;
(3)①负极的电极反应式为:CO+O2--2e-═CO2,故答案为:CO+O2--2e-=CO2;
②该燃料电池的正极反应为:O2+4e-=2O2-,生成的O2-由b极向a极迁移,故答案为:b;a.
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学反应速率,化学平衡常数的计算应用,原电池原理的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4L SO3中含有的氧原子数为3NA |
| B、标准状况下,22.4L Cl2与足量的稀NaOH 溶液反应,转移电子总数为2NA |
| C、1mol N5+共有34NA核外电子 |
| D、0.5mol CCl4中含有共价键数目为4NA |
下列说法中不正确的是( )
| A、高吸水性树脂属于功能高分子材料 |
| B、SiC、Al2O3的熔点很高,可用作高温结构陶瓷 |
| C、光导纤维、合成纤维和人造纤维都是有机高分子化合物 |
| D、合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 |

 用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空:
用18.4mol/L的浓H2SO4配制500ml0.5mol/L的稀H2SO4,请按要求填空: