题目内容
臭氧是理想的烟气脱硝试剂,其脱销反应为:2NO2(g)+O3(g)?N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是( )
| A | B | C | D |
 |  |  |  |
| 升高温度,平衡常数减小 | 0-3s内,反应速率为:v(NO2)=0.2 mol?L-1 | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
| A、A | B、B | C、C | D、D |
考点:真题集萃,化学平衡建立的过程,化学平衡的影响因素
专题:化学平衡专题
分析:A.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,升高温度平衡向逆反应方向移动;
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,根据v=
计算v(NO2),注意选项中单位;
C.使用催化剂,反应速率加快,但平衡不移动;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低.
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,根据v=
| △c |
| △t |
C.使用催化剂,反应速率加快,但平衡不移动;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低.
解答:
解:A.由图可知,反应物总能量高于生成物总能量,正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故A正确;
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,故v(NO2)=
=0.2mol/(L.s),单位错误,故B错误;
C.t1时刻,改变条件,反应速率加快,平衡不移动,该反应前后气体的物质的量减小,不能是增大压强,只能是使用催化剂,但催化剂不影响平衡的移动,故C错误;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低,由图可知,二氧化氮的转化率随x增大而增大,x可以代表O3浓度、压强,故D错误,
故选A.
B.由图可知,0-3s内,二氧化氮的浓度变化量=1mol/L-0.4mol/L=0.6mol/L,故v(NO2)=
| 0.6mol/L |
| 3s |
C.t1时刻,改变条件,反应速率加快,平衡不移动,该反应前后气体的物质的量减小,不能是增大压强,只能是使用催化剂,但催化剂不影响平衡的移动,故C错误;
D.达平衡时,仅增大c(O2),平衡向逆反应方向移动,二氧化氮转化率降低,由图可知,二氧化氮的转化率随x增大而增大,x可以代表O3浓度、压强,故D错误,
故选A.
点评:本题以图象形式,考查化学反应中能量变化、化学反应速率计算、化学平衡图象及影响因素等,难度中等,B选项为易错点,学生容易忽略单位问题.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
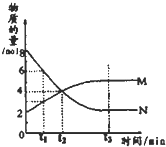 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t3后,若升高温度则反应速率增大 |
某溶液中可能含有下列5中离子中的某几种:Na+、NH4+、Mg2+、Al3+、Cl-.为确认该溶液组成进行如下实验:①取20.0ml该溶液,加入25.0ml4.00mol/LNaOH溶液,有白色沉淀、无刺激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100ml,测得滤液中c(OH-)为0.20mol/L②另取20.0ml该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g由此可得出关于原溶液组成的正确结论是( )
| A、一定含Mg2+、Al3+、Cl-,不含Na+、NH4+ |
| B、一定含Na+、Mg2+、Cl-,不含NH4+,可能含有Al3+ |
| C、c(Cl-)为4.0mol/L,c(Al3+)为1.0mol/L |
| D、c(Mg2+)为1.0mol/L,c(Na+)为0.5mol/L |
元素周期表中某些元素之间存在特殊的对角关系:如 等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
 等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )| A、Be常温下能与水反应 |
| B、Be(OH)2受热不会分解 |
| C、BeO易与水反应 |
| D、Be(OH)2能与强碱反应 |
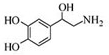 去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示,下列说法正确的是( )
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示,下列说法正确的是( )| A、每个去甲肾上腺素分子中含有3个酚羟基 |
| B、每个去甲肾上腺素分子中含有1个手性碳原子 |
| C、1mol去甲肾上腺素最多与2mol Br2发生取代反应 |
| D、去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
由钠、镁、铝、锌四种金属单质中的两种组成的合金共15g,跟足量的盐酸反应产生5.6L氢气(标准状况),那么此合金中一定含有的金属是( )
| A、Na | B、Mg | C、Al | D、Zn |


