题目内容
磷矿石主要以[Ca3(PO4)2?H2O]和磷灰石[Ca5F(PO4)3,Ca5(OH)(PO4)3]等形式存在,图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解装备磷酸,图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程:

部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的 %;
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为 .现有1t折合含有P2O5约30%的磷灰石,最多可制得到85%的商品磷酸 t.
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是 (填化学式).冷凝塔1的主要沉积物是 ,冷凝塔2的主要沉积物是 .
(4)尾气中主要含有 ,还含有少量的PH3、H2S和HF等.将尾气先通入纯碱溶液,可除去 ;再通入次氯酸钠溶液,可除去 .(均填化学式)
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是 .

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的
(2)以磷矿石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为
(3)如图(b)所示,热法磷酸生产过程的第一步是将SiO2、过量焦炭与磷灰石混合,高温反应生成白磷.炉渣的主要成分是
(4)尾气中主要含有
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是
考点:真题集萃,制备实验方案的设计
专题:创新题型,实验设计题,元素及其化合物
分析:(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒书写化学方程式;根据P元素守恒可得关系式P2O5~2H3PO4,依据此关系式计算;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;根据冷却塔1、2的温度与白磷的熔点比较分析白磷的状态;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3;
(5)相比于湿法磷酸,热法磷酸工艺所得产品纯度大;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒书写化学方程式;根据P元素守恒可得关系式P2O5~2H3PO4,依据此关系式计算;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;根据冷却塔1、2的温度与白磷的熔点比较分析白磷的状态;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3;
(5)相比于湿法磷酸,热法磷酸工艺所得产品纯度大;
解答:
解:(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%,
故答案为:69;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒定律可得反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;
根据P元素守恒可得关系式P2O5~2H3PO4,142份P2O5可制取196份磷酸,1t折合含有P2O5约30%的磷灰石,含有P2O5的质量为0.3t,所以可制得到85%的商品磷酸的质量为
=0.49t,
故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.49;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;冷却塔1的温度是70℃,280.5℃>t>44℃,所以此时主要的沉积物是液态白磷;冷却塔2的温度是18℃,低于白磷的熔点,故此时的主要沉积物是固体白磷,
故答案为:CaSiO3;液态白磷;固态白磷;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3,
故答案为:SiF4、CO;SiF4、H2S、HF;PH3;
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但是所得产品纯度大,杂质少,因此逐渐被采用,
故答案为:产品纯度高.
故答案为:69;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒定律可得反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;
根据P元素守恒可得关系式P2O5~2H3PO4,142份P2O5可制取196份磷酸,1t折合含有P2O5约30%的磷灰石,含有P2O5的质量为0.3t,所以可制得到85%的商品磷酸的质量为
| 196×0.3t |
| 142×85% |
故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.49;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;冷却塔1的温度是70℃,280.5℃>t>44℃,所以此时主要的沉积物是液态白磷;冷却塔2的温度是18℃,低于白磷的熔点,故此时的主要沉积物是固体白磷,
故答案为:CaSiO3;液态白磷;固态白磷;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3,
故答案为:SiF4、CO;SiF4、H2S、HF;PH3;
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但是所得产品纯度大,杂质少,因此逐渐被采用,
故答案为:产品纯度高.
点评:本题考查了化工生产流程图,涉及磷矿石的主要用途、反应原理和有关计算,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,侧重对学生分析问题、解答问题能力的培养和解题方法的指导.

练习册系列答案
相关题目
下列说法正确的是( )
| A、有化学键断裂的过程一定发生化学变化 | ||
| B、氯化钠是一种电解质,电解饱和食盐水可制得金属钠 | ||
C、将pH=a的醋酸稀释为pH=a+1的过程中,
| ||
| D、SiO2是酸性氧化物,能与强碱溶液反应,但不与任何酸反应 |
化学与生产、生活、社会密切相关.下列说法中不正确的是( )
| A、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
| B、绿色化学的核心是从源头上消除工业生产对环境的污染 |
| C、铁在潮湿的空气中放置,易发生化学腐蚀而生锈 |
| D、华商科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的二氧化硅 |
短周期元素X、Y、Z、W的原子序数依次增大.X是原子半径最小的元素;Y原子最外层电子数是次外层的3倍;Z与X处于同一主族,W的原子序数是Y的2倍.下列叙述正确的是( )
| A、原子半径的大小顺序:W>Z>Y>X |
| B、化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| C、元素Y的简单气态氢化物的热稳定性比W的弱 |
| D、由X、Y、Z、W四种元素组成的化合物对水的电离平衡一定是促进的 |
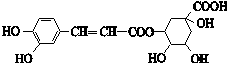 下列有关绿原酸(结构简式如图)的说法不正确的是( )
下列有关绿原酸(结构简式如图)的说法不正确的是( )| A、分子式为C16H18O9 |
| B、1mol绿原酸最多能与8mol NaOH反应 |
| C、1mol绿原酸最多能与4mol H2反应 |
| D、能发生取代反应、消去反应、加成反应和氧化反应 |
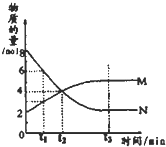 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t3后,若升高温度则反应速率增大 |



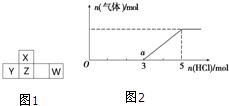 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.