题目内容
14.下列各组物质在溶液中进行反应,可以用同一离子方程式表示的是( )| A. | Na2CO3和HNO3;NaHCO3和HNO3 | B. | BaCl2和Na2CO3;Ba(OH)2和K2CO3 | ||
| C. | Ba(OH)2和NaHSO4;Ba(OH)2和H2SO4 | D. | NaOH和HF;Ba(OH)2和HNO3 |
分析 A.碳酸氢钠电离生成碳酸氢根;
B.反应实质均为碳酸钡与钡离子反应;
C.反应均生成硫酸钡和水;
D.氢氟酸是弱酸.
解答 解:A.碳酸钠电离生成碳酸根,离子方程式:CO32-+2H+=CO2↑+H2O,碳酸氢钠电离生成碳酸氢根,离子方程式:HCO3-+H+=H2O+CO2↑,离子方程式不同,故A错误;
B.反应实质均为碳酸钡与钡离子反应,则能用同一离子方程式表示,离子方程式:Ba2++CO32═BaCO3↓,故B正确;
C.反应均生成硫酸钡和水,则能用同一离子方程式表示,离子方程式:Ba2++2H++2OH-+SO42-═BaSO4↓+2H2O.故C正确
D.氢氟酸是弱酸应分子式表示,离子方程式:HF+OH-═F-+H2O,硝酸是强酸,离子方程式:H++OH-=H2O,离子方程式不同,故D错误.
故选BC.
点评 本题考查离子反应方程式的书写,明确发生的化学反应及离子反应中应保留化学式的物质即可解答,题目难度不大.

练习册系列答案
相关题目
4.与如图图象有关的叙述,正确的是( )
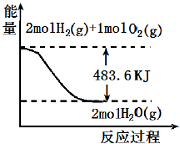

| A. | 表示 2molH2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 | |
| B. | 表示的热化学方程式为:H2(g)+$\frac{1}{2}$02(g)═H20(g)△H=-241.8 kJ/mol | |
| C. | 表示2mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ | |
| D. | H20(g)的能量低于H2(g)和O2(g)的能量之和 |
2.已知25℃时几种弱酸的电离常数如表,下列说法正确的是( )
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液,pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | a mol/L HCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c( Na+)>c(CN-),则a 一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 将少量的H2S通入NaCN溶液中,反应为:H2S+2CN-=2HCN+S2- |
3.下列关于S、Si、N、Cl等非金属元素化合物的说法正确的是( )
| A. | SiO2是制造太阳能电池板的主要材料 | |
| B. | NO、NO2是大气污染物,能在空气中稳定存在 | |
| C. | 漂白精的有效成分是Ca(ClO)2 | |
| D. | Fe与S化合生成Fe2S3 |
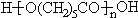 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: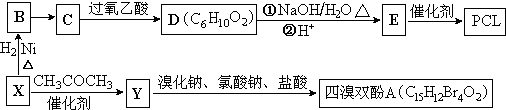


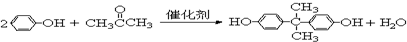 .
.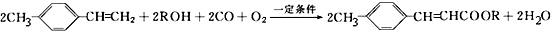
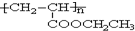 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: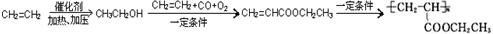 .
.
 ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.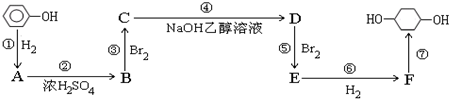
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;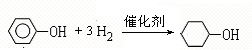 ;
;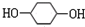 +2NaBr.
+2NaBr.