题目内容
16.下列说法不正确的是( )| A. | “酸雨”、“温室效应”的形成都与化石燃料的燃烧有关 | |
| B. | NaHCO3是焙制糕点所用的发酵粉的主要成分之一 | |
| C. | 氢氧化铁胶体具有吸附性,因而常用于净水 | |
| D. | 硫酸钡在医学上用作钡餐,Ba2+对人体无毒 |
分析 A、酸雨是由NO2和SO2导致的;温室效应是由CO2导致的;
B、NaHCO3可用于食品发酵;
C、氢氧化铁胶体能吸附杂质;
D、Ba2+是重金属离子,能使蛋白质变性.
解答 解:A、酸雨是由NO2和SO2导致的,温室效应是由CO2导致的,而CO2、NO2和SO2的产生均和化石燃料的燃烧有关,故A正确;
B、NaHCO3可用于食品发酵,是食品发酵粉的主要成分之一,故B正确;
C、氢氧化铁胶体能吸附杂质,故可以用于净水,故C正确;
D、Ba2+是重金属离子,能使蛋白质变性,故钡离子有毒,但硫酸钡由于难溶于水和酸,不能电离出钡离子,对人体无毒,故可以作为钡餐,故D错误.
故选D.
点评 本题考查了酸雨的形成、小苏打的用途和重金属盐的性质,难度不大,注意基础的应用.

练习册系列答案
相关题目
6.实验室制备硝基苯的反应原理和实验装置如图:

存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
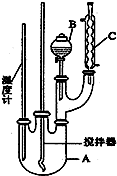
实验步骤如下:
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,将混合酸小心加入B中.把18mL(15.84g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.
回答下列问题:
(1)装置B的名称是分液漏斗.装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.

存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯.
有关数据列如表:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 苯 | 5.5 | 80 | 0.88 | 微溶于水 |
| 硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
| 间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
| 浓硝酸 | 83 | 1.4 | 易溶于水 | |
| 浓硫酸 | 338 | 1.84 | 易溶于水 |

实验步骤如下:
取100mL烧杯,用20mL浓硫酸与18mL浓硝酸配制混和酸,将混合酸小心加入B中.把18mL(15.84g)苯加入A中.向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀.在50~60℃下发生反应,直至反应结束.
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤.分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g.
回答下列问题:
(1)装置B的名称是分液漏斗.装置C的作用是冷凝回流.
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:不能,容易发生迸溅.
(3)为了使反应在50℃~60℃下进行,常用的方法是水浴加热.
(4)在洗涤操作中,第二次水洗的作用是洗去残留的NaOH及生成的盐.
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是以免直形冷凝管通水冷却时导致温差过大而发生炸裂.
(6)本实验所得到的硝基苯产率是72%.
4.与如图图象有关的叙述,正确的是( )


| A. | 表示 2molH2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 | |
| B. | 表示的热化学方程式为:H2(g)+$\frac{1}{2}$02(g)═H20(g)△H=-241.8 kJ/mol | |
| C. | 表示2mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ | |
| D. | H20(g)的能量低于H2(g)和O2(g)的能量之和 |
11.常温下能与水反应且生成强酸的是( )
| A. | SO3 | B. | CO2 | C. | Na2O2 | D. | Na |
1.下列有关物质制备说法不正确的是( )
| A. | 高温下焦炭还原二氧化硅制得粗硅 | |
| B. | 可用Na从TiCl4的水溶液中生产Ti | |
| C. | 可用CO高温下还原赤铁矿炼铁 | |
| D. | 可用石英、石灰石、纯碱在高温下生产玻璃 |
8.下列说法正确的是( )
| A. | 溶液和胶体的本质区别是否有丁达尔效应 | |
| B. | 用pH试纸测定某新制氯水的pH为4 | |
| C. | 酸性氧化物不一定都可与水反应生成酸,金属氧化物不一定是碱性氧化物 | |
| D. | 少量SO2和CO2气体分别通入BaCl2溶液中均有白色沉淀产生 |
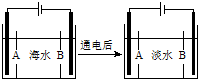 海南某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验.
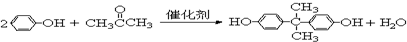
海南某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验. }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:


 .
.
 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: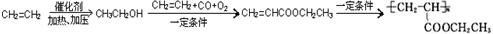 .
. ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.