题目内容
16.甲苯、四氯化碳、己烯、碘化钾溶液、亚硫酸钠溶液均为无色液体,只用一种试剂就可鉴别的是( )| A. | 硝酸银溶液 | B. | 溴水 | ||
| C. | 酸性高锰酸钾溶液 | D. | 氯化铁溶液 |
分析 甲苯和四氯化碳都不溶于水,且二者的密度不同,己烯含有碳碳双键,可发生加成、氧化反应,碘化钾、亚硫酸钠溶于水,具有还原性,根据物质的性质的异同选择合适的鉴别试剂.
解答 解:A.加入硝酸银溶液,不能鉴别甲苯和己烯,二者与硝酸银不反应,且密度都比水小不能鉴别,故A错误;
B.甲苯不溶于水,但密度比水小,四氯化碳不溶于水,但密度比水大,加入溴水,色层位置不同,己烯与溴水发生加成反应,碘化钾与溴水发生氧化还原反应,溶液颜色加深,亚硫酸钠溶液与溴水发生氧化还原反应,溶液褪色,可鉴别,故B正确;
C.甲苯和己烯都与酸性高锰酸钾发生氧化还原反应,不能鉴别,故C错误;
D.氯化铁氧化鉴别碘化钾溶液、亚硫酸钠溶液,不能鉴别甲苯和己烯,故D错误.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握常见有机物的性质及性质差异为解答的关键,注意反应现象相同时不能鉴别物质,侧重萃取及现象的考查,题目难度不大.

练习册系列答案
相关题目
7.下列各组离子在指定溶液中可能大最共存的是( )
| A. | 能使石蕊试液变红色的溶液中:Na+、CO32-、K+、ClO-、I- | |
| B. | 能与金属铝反应放出H2的溶液中:K+、NO3-、Cl-、NH4+ | |
| C. | 常温下水电离出的c(H+)•c(OH-)=10-20mol/L的溶液中:Na+、Cl-、S2-、SO32- | |
| D. | 中性溶液:K+、HCO3-、NO3-、SO42-、Fe3+ |
11.下列通过试剂间两两反应不能鉴别的是( )
| A. | AlCl3溶液和NaOH溶液 | B. | NaAlO2和HCl溶液 | ||
| C. | NaHCO3溶液和HCl溶液 | D. | AgNO3溶液和氨水 |
1.已知反应:2H2O(g)$?_{光照}^{Cu_{2}O}$2H2(g)+O2(g)△H=+484kJ•mol-1.某温度下,在4L密闭容器中加入纳米级Cu2O并通入0.2mol H2O(g),记录不同时间产生O2的物质的量如表:
下列说法正确的是( )
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0020 | 0.0032 | 0.0040 | 0.0040 |
| A. | 前20min的反应速率v(H2O)=2.5×10-5mol•L-1•min-1 | |
| B. | 达平衡时,至少需要从外界吸收的能量为0.968kJ | |
| C. | 增大c(H2O),可以提高水的分解率 | |
| D. | 使用纳米级Cu2O颗粒是为了提高催化效果 |
8.硫代硫酸钠溶液与稀硫酸的反应为Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,某兴趣小组以该反应为例探究反应速率的影响因素并设计了如下实验,下列说法不正确的是( )
| 实验 序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| 1 | 25 | 5 | 0.1 | 10 | 0.1 | 5 |
| 2 | 25 | 5 | 0.2 | 5 | 0.2 | 10 |
| 3 | 35 | 5 | 0.1 | 10 | 0.1 | 5 |
| A. | 实验1和实验2可以探究Na2S2O3浓度对反应速率的影响 | |
| B. | 实验1和实验3可以探究温度对反应速率的影响 | |
| C. | 通过测定单位时间内收集到气体的体积判断化学反应速率快慢 | |
| D. | 实验3时,应先分别将Na2S2O3溶液、H2SO4溶液和水置于热水浴中加热到所需温度再混合发生反应,记录反应所需时间 |
5.下列物质中属于盐的是( )
| A. | MgO | B. | H2SO4 | C. | NaOH | D. | KNO3 |
 ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧SO2.
 ,F
,F ;A含有的官能团名称是羟基;
;A含有的官能团名称是羟基;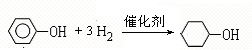 ;
; +2NaBr.
+2NaBr.