题目内容
9. 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-═Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
分析 该装置中氯原子在银电极上得电子发生还原反应,所以银作正极、铂作负极,电流从负极沿导线流向正极,电解质溶液中阴离子向负极移动.
解答 解:该装置中氯原子在银电极上得电子发生还原反应,所以银作正极、铂作负极,
A.光照时,电流从正极银X流向负极铂Y,故A错误;
B.光照时,Pt电极作负极,负极上亚铜离子失电子发生氧化反应,电极反应式为)Cu+(aq)-e-=Cu2+(aq),故B错误;
C.光照时,该装置是原电池,银作正极,铂作负极,电解质中氯离子向负极铂移动,故C错误;
D.光照时,正极上氯原子得电子发生还原反应,负极上亚铜离子失电子,所以电池反应式为AgCl(s)+Cu+(aq)$\frac{\underline{\;光照\;}}{\;}$Ag(s)+Cu2+(aq)+Cl-(aq),故D正确;
故选D.
点评 本题考查了原电池原理,根据图中得失电子确定正负极,再结合电流方向、电极反应来分析解答,原电池原理通常与电解原理同时考查,涉及金属的腐蚀与防护、电解精炼、电镀等知识点,有时还考查实验设计,注意基础知识的积累和灵活运用.

练习册系列答案
相关题目
19.在装有浓硫酸的容器上应贴的标志是( )
| A. |  | B. |  | C. |  | D. |  |
17.将SO2气体通入BaCl2溶液中,没有看到明显现象,再通入一种气体(或加入一种物质)后,可产生一种白色沉淀,该气体(或物质)不可能是( )
| A. | Cl2 | B. | NH3 | C. | CO2 | D. | FeCl3 |
4.我国农业因遭受酸雨而造成每年损失高达十五多亿元.为了有效控制酸雨,目前国务院已批准了《酸雨控制区和二氧化硫污染控制区划分方案》等法规.
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如表:
分析数据,完成下列问题:
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4
②如果将刚取样的上述雨水和自来水相混合,pH将变小(填“大”或“小”),原因是(用化学方程式表示)SO2+2H2O+Cl2=H2SO4+2HCl.
(2)要测定空气中SO2 的含量,某同学设计如下方案:
将空气以恒定速率x L/min缓慢通入10mL 0.001mol/L酸性高锰酸钾溶液,当一段时间t后通入5m3空气时,溶液恰好褪色(假定空气中其它成分不与酸性高锰酸钾反应).
①写出SO2 与酸性高锰酸钾反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+(反应后锰元素以Mn2+ 形式存在).
②SO2 使高锰酸钾溶液褪色体现SO2 的性质是B(填选项)
A.氧化性 B.还原性 C.漂白性 D.酸性氧化物通性
③空气中SO2 的含量为0.32mg/m3
④使溶液褪色所需的时间t越长,则空气中SO2 的含量越小(填“大”或“小”)
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如表:
| 测试时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
①雨水样品的pH变化的原因是(用化学反应方程式表示)2H2SO3+O2=2H2SO4
②如果将刚取样的上述雨水和自来水相混合,pH将变小(填“大”或“小”),原因是(用化学方程式表示)SO2+2H2O+Cl2=H2SO4+2HCl.
(2)要测定空气中SO2 的含量,某同学设计如下方案:
将空气以恒定速率x L/min缓慢通入10mL 0.001mol/L酸性高锰酸钾溶液,当一段时间t后通入5m3空气时,溶液恰好褪色(假定空气中其它成分不与酸性高锰酸钾反应).
①写出SO2 与酸性高锰酸钾反应的离子方程式5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+(反应后锰元素以Mn2+ 形式存在).
②SO2 使高锰酸钾溶液褪色体现SO2 的性质是B(填选项)
A.氧化性 B.还原性 C.漂白性 D.酸性氧化物通性
③空气中SO2 的含量为0.32mg/m3
④使溶液褪色所需的时间t越长,则空气中SO2 的含量越小(填“大”或“小”)
1.雾霾天气是一种大气污染状态,雾霾的源头多种多样,比如汽车尾气、工业排放、建筑扬尘、垃圾焚烧,甚至火山喷发等.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
请完成汽车尾气净化中NO(g)和CO(g)发生反应的热化学方程式
2NO(g)+2CO( g)?N2( g)+2CO2(9)△H=-538kJ/mol
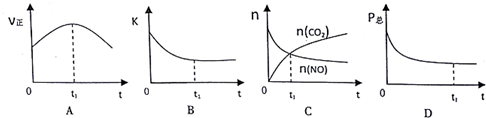
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图
不符合题意的是ABC(填选项序号).(下图中V正、K、n、P总分别表示正反应速率、平衡常
数、物质的量和总压强)
(2)在t1℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如表:
t1℃时该反应的平衡常数K=500,既能增大反应速率又能使平衡正向移动的措施是加压.(写出一种即可)
(3)如图l所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式N2O4+2HNO3-2e-=2N2O5+2H+.
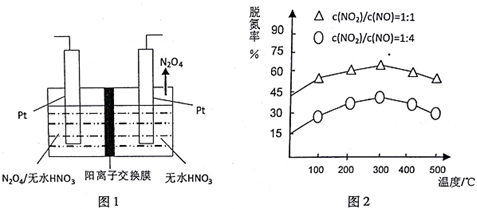
(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小,给出合理的解释:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
(1)汽车尾气中的NO(g)和CO(g)在一定温度和催化剂的条件下可净化.
①已知部分化学键的键能如下
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
2NO(g)+2CO( g)?N2( g)+2CO2(9)△H=-538kJ/mol
②若上述反应在恒温、恒容的密闭体系中进行,并在t.时刻达到平衡状态,则下列示意图
不符合题意的是ABC(填选项序号).(下图中V正、K、n、P总分别表示正反应速率、平衡常
数、物质的量和总压强)

(2)在t1℃下,向体积为10L的恒容密闭容器中通人NO和CO,测得了不同时间时NO和CO的物质的量如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/×10-2mol | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| n(CO)/×10-1mol | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(3)如图l所示,以N2O4为原料采用电解法可制备新型绿色硝化剂(一种氮氧化物)写出生成这种硝化剂的阳极电极反应式N2O4+2HNO3-2e-=2N2O5+2H+.

(4)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术.在氨气足量的情况下,不同c(NO2)/C(NO)、不同温度对脱氮率的影响如图2所示(已知氨气催化还原氮氧化物的正反应为放热反应),请回答温度对脱氮率的影响300℃之前,温度升高脱氮率逐渐增大,而300℃之后,温度升高脱氮率逐渐减小,给出合理的解释:300℃之前,反应未平衡,反应向右进行,脱氮率增大;300℃时反应达平衡,后升温平衡逆向移动,脱氮率减小.
18.常温下,下列各组离子在指定环境中能大量共存的是( )
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010的溶液中:Na+ ${NH}_{4}^{+}$ HCO${\;}_{3}^{-}$ Cl- | |
| B. | 含有大量ClO-的溶液中:K+ OH- Na+ ${SO}_{3}^{2-}$ | |
| C. | c(Al3+)=0.1 mol?L-1的溶液中:Na+ NO${\;}_{3}^{-}$ AlO${\;}_{2}^{-}$ ${SO}_{4}^{2-}$ | |
| D. | 澄清透明的溶液中:Cu2+ Fe3+ NO${\;}_{3}^{-}$ Cl- |

 已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行):
已知A是由两种中学常见元素组成的化合物,H、D为白色沉淀,E的焰色反应为黄色.A~H各物质之间的关系如图(反应中部分产物已略去,除气体间的反应物外,其余反应均在溶液中进行): .
.