题目内容
下列说法正确的是( )
| A、SO2通入品红溶液,溶液褪色的原理与SO2通入溴水后褪色的原理相同 |
| B、浓硫酸具有强氧化性,稀硫酸不具有氧化性 |
| C、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| D、明矾和漂白粉常用于自来水的净化和杀菌消毒,但二者的作用原理不同 |
考点:二氧化硫的化学性质,盐类水解的应用,氯、溴、碘及其化合物的综合应用,浓硫酸的性质,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:A.依据二氧化硫的漂白性和还原性解答;
B.稀硫酸中氢离子处于最高价态,具有氧化性;
C.FeCl3溶液和NaOH溶液反应生成氢氧化铁沉淀;
D.明矾净水是由于铝离子水解生成氢氧化铝胶体具有吸附性,漂白粉杀菌消毒是因为其具有强的氧化性.
B.稀硫酸中氢离子处于最高价态,具有氧化性;
C.FeCl3溶液和NaOH溶液反应生成氢氧化铁沉淀;
D.明矾净水是由于铝离子水解生成氢氧化铝胶体具有吸附性,漂白粉杀菌消毒是因为其具有强的氧化性.
解答:
解:A.SO2使品红褪色体显漂白性,通入溴水后褪色体现二氧化硫的还原性,故A错误;
B.浓硫酸具有强氧化性,稀硫酸中氢离子处于高价态,能够得到电子,所以稀硫酸具有氧化性,故B错误;
C.FeCl3溶液和NaOH溶液反应生成氢氧化铁沉淀,得不到胶体,故B错误;
D.明矾净水是由于铝离子水解生成氢氧化铝胶体具有吸附性,漂白粉杀菌消毒是因为其具有强的氧化性,二者原理不同,故D正确;
故选:D.
B.浓硫酸具有强氧化性,稀硫酸中氢离子处于高价态,能够得到电子,所以稀硫酸具有氧化性,故B错误;
C.FeCl3溶液和NaOH溶液反应生成氢氧化铁沉淀,得不到胶体,故B错误;
D.明矾净水是由于铝离子水解生成氢氧化铝胶体具有吸附性,漂白粉杀菌消毒是因为其具有强的氧化性,二者原理不同,故D正确;
故选:D.
点评:本题考查了常见物质二氧化硫、硫酸、明矾、漂白粉等的性质,题目难度不大,注意氧化性的酸和酸的氧化性的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列实验,能达到实验目的是( )
A、 配置一定物质的量浓度的H2SO4溶液 |
B、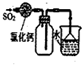 收集和吸收多余的SO2 |
C、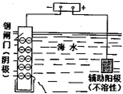 保护钢闸门不被腐蚀 |
D、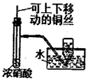 制取和收集NO2 |
下列离子或分子组中大量共存且满足相应要求的是( )
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 |
| C、Na+、K+、Ag+、NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 |
| D、NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
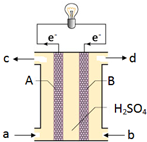 “长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )
“长征”火箭发射使用的燃料是偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分).某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,下列说法正确的是( )| A、B为正极 |
| B、从a口通入四氧化二氮气体 |
| C、从d口排除的是NO气体 |
| D、A极发生的电极反应式:C2H8N2-16e-+8H2O=CO2+N2+16H+ |
某反应的△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能不小于100kJ?mol-1 |
| B、正反应活化能小于100kJ?mol-1 |
| C、逆反应活化能一定小于100kJ?mol-1 |
| D、正反应活化能比逆反应活化能小100kJ?mol-1 |
某有机物的结构如图所示,下列有关它的说法正确的是( )
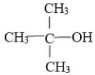

| A、能与氢氧化钠溶液反应 |
| B、4个碳原子可能在同一平面内 |
| C、与它具有相同官能团的同分异构体还有4种 |
| D、与乙醇互为同系物 |
人的血液中存在H2CO3~HCO3-这样“一对”物质,前者的电离和后者的水解两个平衡使正常人血液的pH保持在7.35~7.45之间.血液中注射碱性物质时,上述电离和水解受到的影响分别是( )
| A、促进、促进 |
| B、促进、抑制 |
| C、抑制、促进 |
| D、抑制、抑制 |
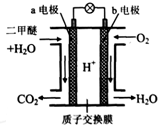 二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )
二甲醚是一种绿色、可再生的新能源.如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法不正确的是( )| A、a电极为该电池负极 |
| B、当有0.4mol电子转移时,b极消耗O2 2.24L |
| C、电池工作时,a电极反应式:CH3OCH3-12e-+3H2O→2CO2↑+12H+ |
| D、电池工作时,燃料电池内部H+从a电极移向b电极 |
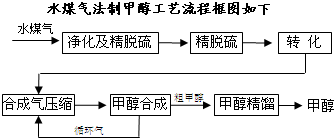 将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域.