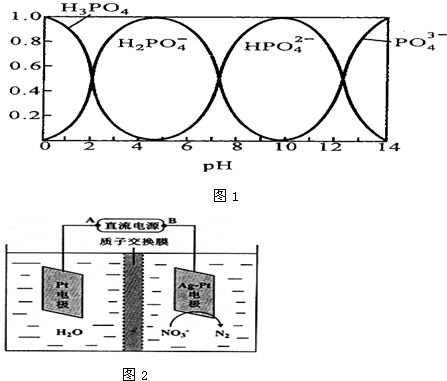
题目内容
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)?M(g)+N(g),所得实验数据如表:
下列说法正确的是( )
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
| A、实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率v(N)=1.0×10-2mol/(L?min) |
| B、实验②中,该反应的平衡常数K=2.0 |
| C、实验③中,达到平衡时,X的转化率为60% |
| D、实验④中,达到平衡时,b>0.060 |
考点:真题集萃,化学平衡建立的过程
专题:化学平衡专题
分析:A、根据v=
计算v(M),在利用速率之比等于化学计量数之比计算v(N);
B、由表中数据,利用三段式计算平衡时其它组分的物质的量,由于反应中气体的化学计量数相等,可以用物质的量代替浓度代入平衡常数表达式计算;
C、温度不变平衡常数不变,根据平衡常数可求出转化量,进而求出转化率;
D、对比实验①②的平衡常数可知,正反应为放热反应,升温平衡左移,平衡常数减小,转化率减小,根据实验③中X的转化率为60%,则实验④中X的转化率小于60%,达到平衡时,b<0.060.
| △c |
| △t |
B、由表中数据,利用三段式计算平衡时其它组分的物质的量,由于反应中气体的化学计量数相等,可以用物质的量代替浓度代入平衡常数表达式计算;
C、温度不变平衡常数不变,根据平衡常数可求出转化量,进而求出转化率;
D、对比实验①②的平衡常数可知,正反应为放热反应,升温平衡左移,平衡常数减小,转化率减小,根据实验③中X的转化率为60%,则实验④中X的转化率小于60%,达到平衡时,b<0.060.
解答:
解:A.v(N)=v(M)=
=
=1.0×10-3mol/(L?min),故A错误;
B. X(g)+Y(g)?M(g)+N(g)
起始浓度(mol/L) 0.01 0.04 0 0
转化浓度(mol/L) 0.008 0.008 0.008 0.008
平衡浓度(mol/L) 0.002 0.032 0.008 0.008
实验②中,该反应的平衡常数K=
=
=1.0,故B错误;
C. X(g)+Y(g)?M(g)+N(g)
起始浓度(mol/L) 0.02 0.03 0 0
转化浓度(mol/L)
平衡浓度(mol/L) 0.02-
0.03-
该反应的平衡常数K=
=
=1.0,解得a=0.12,实验③中,X的转化率=
×100%=60%,故C正确;
D.根据三段式可求得,700℃时,化学平衡常数K≈2.6,升高温度至800℃得平衡常数为K=1.0,K减小,即平衡逆向移动,则正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,④与③为等效平衡,b=
a=0.06mol,但④的实际温度为900℃,相比较800℃,平衡逆向移动,b<0.06,故D错误;
故选C.
| △c |
| △t |
| 0.05mol |
| 10L×5min |
B. X(g)+Y(g)?M(g)+N(g)
起始浓度(mol/L) 0.01 0.04 0 0
转化浓度(mol/L) 0.008 0.008 0.008 0.008
平衡浓度(mol/L) 0.002 0.032 0.008 0.008
实验②中,该反应的平衡常数K=
| c(M)c(N) |
| c(X)c(Y) |
| 0.008×0.008 |
| 0.002×0.032 |
C. X(g)+Y(g)?M(g)+N(g)
起始浓度(mol/L) 0.02 0.03 0 0
转化浓度(mol/L)
| a |
| 10 |
| a |
| 10 |
| a |
| 10 |
| a |
| 10 |
平衡浓度(mol/L) 0.02-
| a |
| 10 |
| a |
| 10 |
| a |
| 10 |
| a |
| 10 |
该反应的平衡常数K=
| c(M)c(N) |
| c(X)c(Y) |
| ||||
(0.02-
|
| 0.12 |
| 0.2 |
D.根据三段式可求得,700℃时,化学平衡常数K≈2.6,升高温度至800℃得平衡常数为K=1.0,K减小,即平衡逆向移动,则正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,④与③为等效平衡,b=
| 1 |
| 2 |
故选C.
点评:本题考查化学反应速率、化学平衡常数、化学平衡的影响因素等,难度中等.

练习册系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、水电离出的c(H+)?c(OH-)=10-22的溶液:K+、Na+、SO42-、S2O32- |
| B、澄清透明溶液:Mg2+、Cu2+、Cl-、SO42- |
| C、使酚酞变红色的溶液:NH4+、K+、AlO2-、NO3- |
| D、含0.1mol?L-1 KI的溶液:Fe3+、Na+、NO3-、Cl- |
炼钢时常用的氧化剂是空气(或纯氧).炼钢过程中既被氧化又被还原的元素是( )
| A、铁 | B、硫 | C、氧 | D、碳 |
下列实验,能达到实验目的是( )
A、 配置一定物质的量浓度的H2SO4溶液 |
B、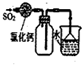 收集和吸收多余的SO2 |
C、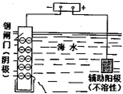 保护钢闸门不被腐蚀 |
D、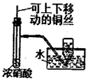 制取和收集NO2 |
以下关于原子的未成对电子数的叙述正确的是( )
①钠、铝、氯:1个;②硅、硫:2个;③磷:3个;④铁:4个.
①钠、铝、氯:1个;②硅、硫:2个;③磷:3个;④铁:4个.
| A、只有①③ | B、只有①②③ |
| C、只有②③④ | D、有①②③④ |
下列离子或分子组中大量共存且满足相应要求的是( )
| A、K+、AlO2-、Cl-、MnO4- 要求:无色澄清溶液 |
| B、Fe3+、NO3-、I-、HCO3- 要求:逐滴滴加盐酸立即产生气体 |
| C、Na+、K+、Ag+、NO3- 要求:逐滴滴加氨水先有沉淀产生,后沉淀消失 |
| D、NH4+、Al3+、SO42-、CH3COOH 要求:滴加NaOH浓溶液立刻产生气体 |
某反应的△H=+100kJ?mol-1,下列有关该反应的叙述正确的是( )
| A、正反应活化能不小于100kJ?mol-1 |
| B、正反应活化能小于100kJ?mol-1 |
| C、逆反应活化能一定小于100kJ?mol-1 |
| D、正反应活化能比逆反应活化能小100kJ?mol-1 |
下列对金、银、铜的描述错误的是( )
| A、金具有极高的抗腐蚀性、优良的导热、导电性 |
| B、银可用作有机合成催化剂、电池等材料 |
| C、Cu属于不活泼金属,在潮湿的空气中不易被腐蚀 |
| D、铜具有良好的导电性,大量用于制造电线、电缆 |