题目内容
18.科学家寻找高效催化剂实现大气污染物转化:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=-283kJ•moL-1.几种化学键的键能数据如下:
| 化学键 | N≡N键 | O=O键 | = ← N O键 |
| 键能/kJ•moL-1 | 945 | 498 | 630 |
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后,电解质溶液中离子浓度大小顺序为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),则负极的反应式为CO-2e-+3OH-=HCO3-+H2O
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数表达式为K=$\frac{c(N2)•c2(CO2)}{c2(NO)•c2(CO)}$.图A中曲线Ⅱ(填“Ⅰ”或“Ⅱ”)能正确表示平衡常数与温度的关系,理由是该可逆反应的正反应为放热反应,升温平衡逆移,平衡常数减小.
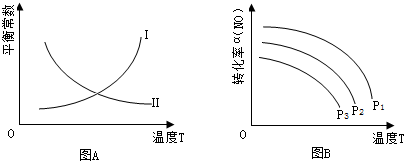
(4)当NO、CO浓度比为1时,体系中NO平衡转化率的平衡转化率(α)与温度、压强的关系如图B所 示.图B中,压强由小到大的顺序为P3<p2<p1,其判断理由是正反应是气体分子数减小的反应,其他条件不变时增大压强,平衡正移,NO转化率增大.
分析 (1)化学反应焓变=反应物键能总和-生成物键能总和计算,CO的燃烧热△H2=-283kJ•moL-1,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,根据表中数据以及盖斯定律来计算;
(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子存在形式确定电极反应;
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数等于产物平衡浓度系数次幂之积和反应物平衡浓度系数次幂之积的比值;
(4)2CO(g)+2NO(g)?N2(g)+2CO2(g)中,温度不变,增大压强,正向移动,据此回答.
解答 解:(1)焓变=反应物键能总和-生成物键能总和,则反应①N2(g)+O2(g)=2NO(g)△H3=945kJ/mol+498kJ/mol-630kJ/mol×2=+183 kJ•moL-1,CO的燃烧热△H2=-283kJ•moL-1,即2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol ②,②-①得到2CO(g)+2NO(g)?N2(g)+2CO2(g),所以2CO(g)+2NO(g)?N2(g)+2CO2(g),△H1=-566kJ/mol-183 kJ•moL-1=-749kJ•moL-1,
故答案为:+183 kJ•moL-1;-749kJ•moL-1;
(2)CO与空气在KOH溶液中构成燃料电池中,负极上CO发生失电子的氧化反应,根据离子浓度大小关系,得到电极反应式为;CO-2e-+3OH-=HCO3-+H2O,故答案为:CO-2e-+3OH-=HCO3-+H2O;
(3)2CO(g)+2NO(g)?N2(g)+2CO2(g)的平衡常数K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,反应释放热量,所以温度升高,K减小,图A中曲线Ⅱ能正确表示平衡常数与温度的关系,故答案为:K=$\frac{c({N}_{2})•{c}^{2}(C{O}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$;Ⅱ;该可逆反应的正反应为放热反应,升温平衡逆移,平衡常数减小;
(4)2CO(g)+2NO(g)?N2(g)+2CO2(g)中,温度不变,增大压强,正向移动,所以NO平衡转化率增加,所以P3<p2<p1,
故答案为:P3<p2<p1;正反应是气体分子数减小的反应,其他条件不变时增大压强,平衡正移,NO转化率增大.
点评 本题考查了热化学方程式的书写及计算,题目难度中等,明确盖斯定律的含义为解答关键,注意掌握焓变与反应物、生成物键能的关系,试题培养了学生的化学计算能力.

| A. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 | |
| B. | 醋酸溶液的浓度小于盐酸 | |
| C. | 两种溶液中由水电离出来的c(H+)不相同 | |
| D. | 分别用蒸馏水稀释相同倍数后,盐酸的pH大于醋酸的pH |
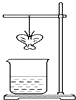 某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )
某同学用滤纸折成一个纸蝴蝶并喷洒一种溶液(保持湿润),挂在铁架台上.另取一只盛某种溶液的烧杯,放在纸蝴蝶的下方(如图).过一会,发现纸蝴蝶变为红色.如表的组合中,能够实现上述变化的是( )| A | B | C | D | |
| 纸蝴蝶上的喷洒液 | 酚酞 | 酚酞 | 石蕊 | 石蕊 |
| 小烧杯中的溶液 | 浓氨水 | 浓NaOH | 浓盐酸 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 少量金属钠加到冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | NaHCO3溶液中滴加少量Ca(OH)2溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 硫酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 将2 mol/L AlCl3溶液和7 mol/L NaOH溶液等体积混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O |
| A. | 0.1mol/L醋酸溶液中:c(H+)=c(CH3COO- )+c(OH- ) | |
| B. | 中和pH与体积都相同的硫酸和醋酸,消耗NaOH的量后者大于前者 | |
| C. | 由水电离的H+浓度为1.0×10-4mol/L的溶液,pH一定等于4 | |
| D. | NaHCO3溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(OH-)>c(H+) |
| A. | 钠能与冷水剧烈反应,而铝不能与冷水反应 | |
| B. | NaOH易溶于水,Al(OH)3难溶于水 | |
| C. | 等物质的量的NaOH和Al(OH)3,Al(OH)3可以电离出更多OH- | |
| D. | 等物质的量铝比钠失去电子数多 |
 .
.